今天刚刚!美国FDA批准首个非处方...

美国食品和药物管理局
批准首个 COVID-19 家用抗原检测试剂盒上市!
首个非处方(OTC)COVID-19
抗原检测试剂盒上市
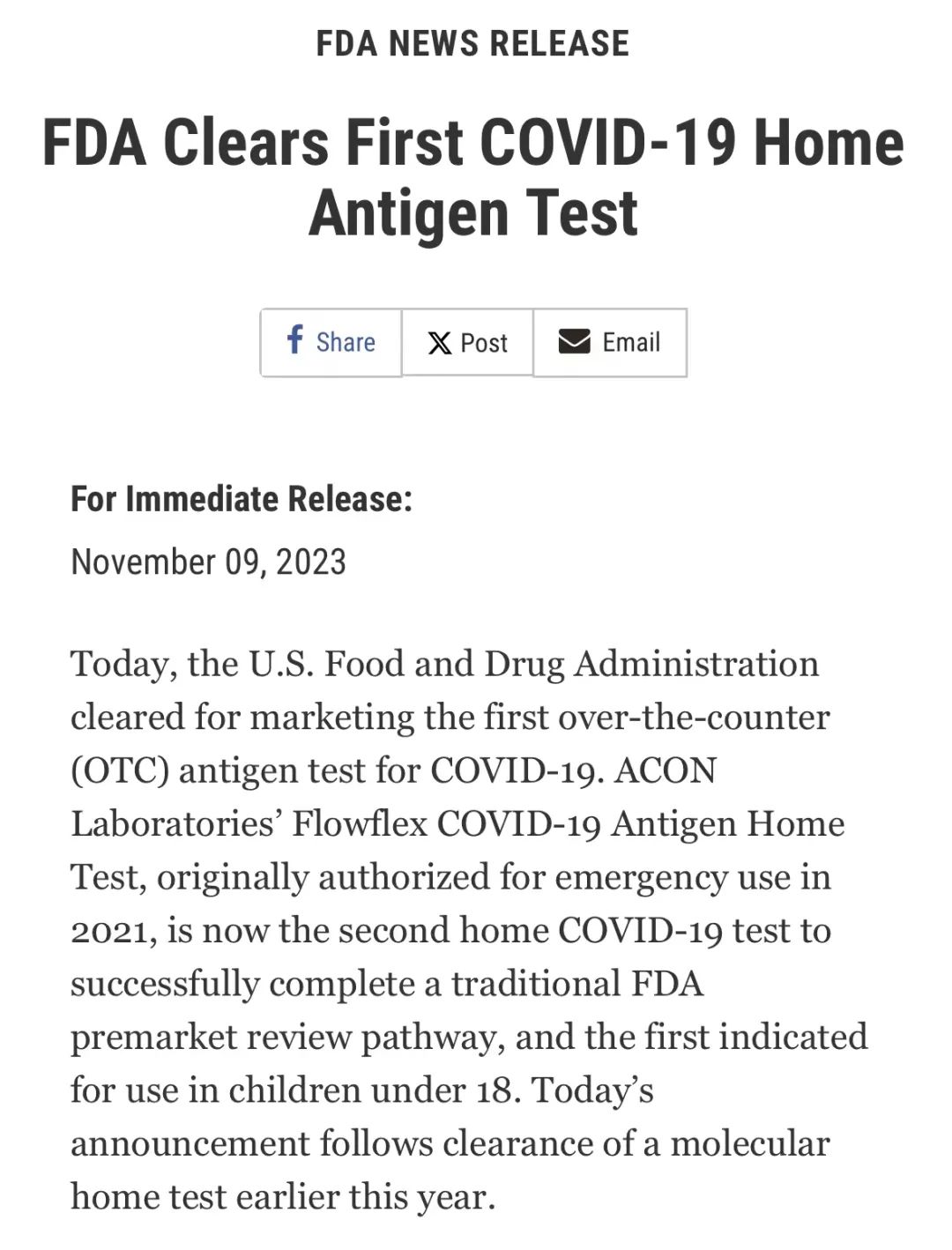
今天,美国食品和药物管理局批准了首个非处方(OTC)COVID-19抗原检测试剂盒上市。
ACON Laboratories的Flowflex COVID-19抗原家用检测试剂盒最初于2021年获准用于紧急用途EUA,现在是第二款成功通过美国食品药品管理局传统上市前审查途径的COVID-19家用检测试剂盒,也是第一款适用于18岁以下儿童的检测试剂盒。
继今年早些时候一项分子家用检测获得批准后,今天又宣布了这一消息。

FDA 器械与放射卫生中心主任、医学博士、法学博士杰夫-舒伦(Jeff Shuren)说:
"这标志着我们在努力帮助测试开发商为美国人提供安全有效的 COVID 测试选择方面又向前迈进了一步。
食品及药物管理局将继续积极主动地与希望在紧急使用授权之外销售其产品的测试开发商合作。这是 FDA 更广泛努力的一部分,目的是推动针对各种医疗状况的居家检测的开发和可用性,以扩大患者获得检测的机会。"
Flowflex COVID-19
抗原家用检测试剂盒
Flowflex COVID-19 抗原家用检测试剂盒是一种可视读取的检测试剂盒,获准在症状出现后六天内供有症状的个人在家中使用。
它适用于 14 岁或 14 岁以上的人进行自我检测,或适用于成人对 2 岁或 2 岁以上的人进行检测。
在美国食品及药物管理局审查的一项研究中,在有上呼吸道感染症状和体征的人中,该检测能正确识别 89.8%的阳性样本和 99.3%的阴性样本。
使用注意事项
与获准用于紧急用途的抗原检测一样,该检测应在三天内至少使用两次,两次检测之间至少间隔 48 小时。
这就意味着,对于初次检测结果为阴性的有症状者,应在第一次检测后的 48 至 72 小时内使用 COVID-19 抗原检测法或 COVID-19 分子检测法再次进行检测。
510(k) 上市前审查
FDA 通过 510(k) 上市前审查途径审查了 ACON Flowflex COVID-19 抗原家庭检测试剂盒。
510(k)是向美国食品药品管理局提交的上市前申请,以证明新产品与合法上市的产品实质上等同。