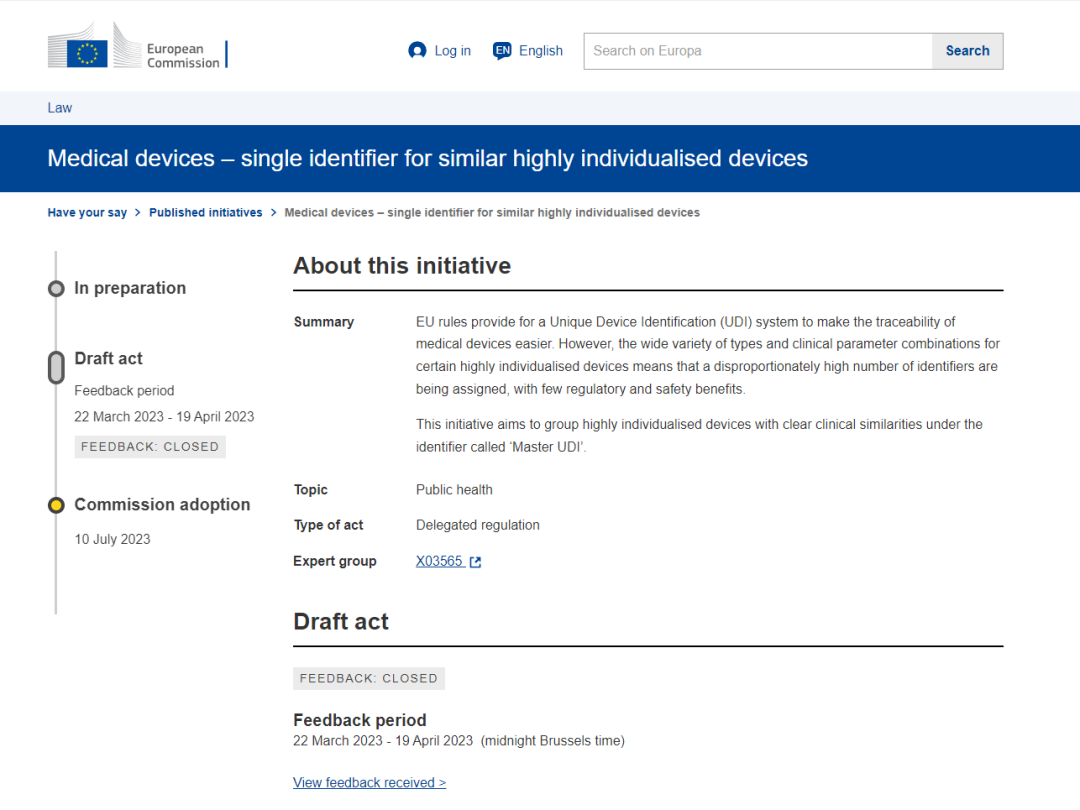
快讯 | 欧盟委员会通过有关隐形眼镜产品UDI规则新法案

当地时间7月10日,欧盟委员会通过了MDR的新提案草案的决议,为“高度个性化”产品创建“Master UDI-DI”,以达到通过 Master UDI-DI 的引入将具有高度个性化的器械组合在一起,从而减少进入 EUDAMED 数据库条目的数量。
背景信息
此次通过的草案是于当地时间2023年3月22日进行内容的发布,并公告至2023年4月19日收集意见后的过审版本。
前情回顾:再添一类UDI-DI信息解决信息冗余,欧盟委员会发布MDR新提案草案
涉及范围
目前,被视为“高度个性化”的产品类型是隐形眼镜。文件指出,在欧盟和其他国家/地区实施UDI系统的经验表明,某些设备具有“高度个性化”,导致需要报告UDI-DIs条目的比例过高,例如在欧盟的UDI数据库EUDAMED中。与其他医疗器械相比,这些设备具有特定临床相关参数相似性,存在大量相同的信息而造成大量信息冗余。因此,在这种情况下,Master UDI-DI被开发出来作为高度个性化产品(如隐形眼镜)的标识信息。
虽然更新后的法规现在仅涵盖隐形眼镜,但更多产品使用 Master UDI-DI 系统已进入被探讨的序列。
关于 Master UDI-DI
“Master UDI-DI”与“Basic UDI-DI”是两个独立的标识符。Master UDI-DI 不会取代 Basic UDI-DI。
如果一个医疗器械被认为是“高度个性化的”并且有资格获得Master UDI-DI,那么它需要Basic UDI-DI 和Master UDI-DI。
生效时间
虽然此次通过的新内容将于在欧盟官方公报(OJEU)上发布 20 天后生效,但制造商已经可以开始为其产品分配主 UDI-DI。
对于新的产品UDI管理方式,普瑞纯证也将持续关注其他需要定向管理产品UDI的扩增内容进展。

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化AI赋能生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,500万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
