让医械专家小组为你的产品提供临床试验有关的科学建议?EMA正式开放了申请入口

作为当地时间1月25日的线上会议延续,European Medicines Agency(欧洲药品管理局,EMA)关于开展 高风险医疗器械生产商就临床开发与研究提供科学建议的试点项目2月27日正式在其官网开放了申请入口。
点击图片即刻访问“全球法规“小程序,了解原文及申请入口
医疗器械专家小组将向选定的十位申请者就临床开发策略或临床研究建议提供免费建议。该试点项目将持续约一年时间,并将帮助建立有效的科学建议程序。
在EMA看来,此举是促进产品创新的重要措施,并且有利于帮助患者更快获得更加安全有效的医疗产品。同时,EMA鼓励中小企业积极提交意向申请书。

试点项目将优先考虑以下类型的医疗设备:
在疾病的诊断或治疗中,让小部分患者受益的设备,如名为“orphan devices” (孤儿装置),用于治疗一种罕见病症的设备 或是供儿科使用的设备;
在目前医疗替代方案不足,或是存在重大隐患的情况下,能够改善医疗条件,以免危及生命、或导致身体功能永久性损伤的设备;
可能对临床或健康产生重大影响的新型设备;
项目分为两个阶段,四月份时将确定前五名申请者名单。
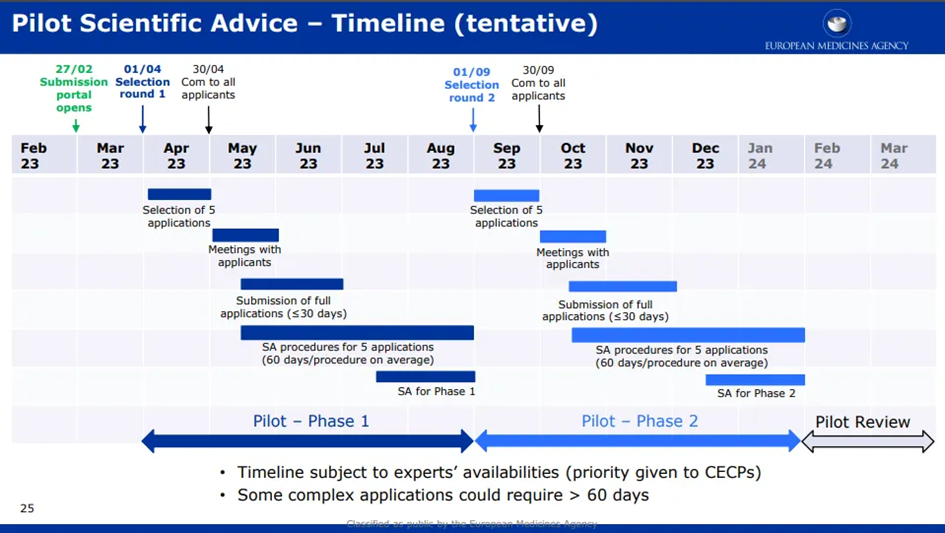
试点项目完成后,EMA 将对流程、申请人和专家小组的参与过程进行评估,并将与相关方举行会议,讨论其可能的优化方案。
对于公告机构在某些高风险医疗器械和体外医疗器械诊断的认证范围内进行的临床评估,医疗器械专家小组将就其提供意见和看法。

左右滑动查看更多
普瑞纯证也将持续关注申请与后续的进展,如果您有任何疑问也可以与我们的客服专家进行沟通。

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-
普瑞纯证是行业领先的全球化 SaaS+Data 生命科学服务商,我们的全球服务网络分布在包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。