看了Paxlovid的产品说明书后,我们发现适用人群并没有想象中大
近期Paxlovid作为治疗新冠的神药一直在朋友圈刷屏,同时印度的相关仿制药也层出不穷。
我们在pfizer.com网站上找到了中文说明书。后台回复“说明书”,直接获取产品说明书源文件。
可能很多朋友出于孝心或者担心,给自己或家中的老人买了这药,也许有些花的钱还不少,但是这药的适用窗口和人群很窄,禁止联用的药品很多,请一定认真阅读说明书,并在经过小分子药物培训的医生处方下指导使用。
我们也整理了部分重要信息以供了解。
Paxlovid 作用机制
是一种 SARS-CoV-2 主要蛋白酶 Mpro(也称为 3C-样蛋白酶,3CLpro)的拟肽类抑制剂,抑制 SARS-CoV-2 Mpro 可使其无法处理多蛋白前体,从而阻止病毒复制。
Paxlovid 适应症
用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者。
如伴有以下至少一种疾病或条件,则认为具有进展为重症 COVID-19 的高风险因素:
高龄(如:≥ 60 岁)
肥胖或超重(如:体重指数[BMI]>25 kg/m2)
目前吸烟者
慢性肾脏疾病
糖尿病
免疫抑制性疾病或免疫抑制治疗
心血管疾病(包括先天性心脏病)或高血压
慢性肺病(如:慢性阻塞性肺病、哮喘[中度至重度]、间质性肺疾病、囊性纤维化和肺动脉高压)
镰状细胞病
神经发育性疾病(例如:脑性麻痹、唐氏综合征)或导致医学复杂性的其他病症(如:遗传或代谢综合征和重度先天性异常)
活动性癌症
需要相关医疗性支持(与COVID-19无关)(如:气管切开术、胃造瘘术或正压通气等)
本品的批准使用不仅限于上述医学状况或因素,其他医学状况或因素(如:人种或种族)也可能使个体患者处于进展为重症 COVID-19 的高风险,应权衡个体患者的获益与风险。
本品为附条件批准上市,需后续对所附条件相关研究数据评估后确认其用于中国患者的有效性和安全性。
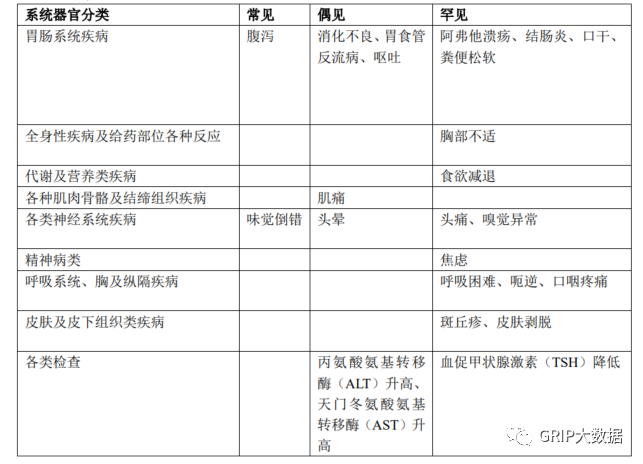
不良反应
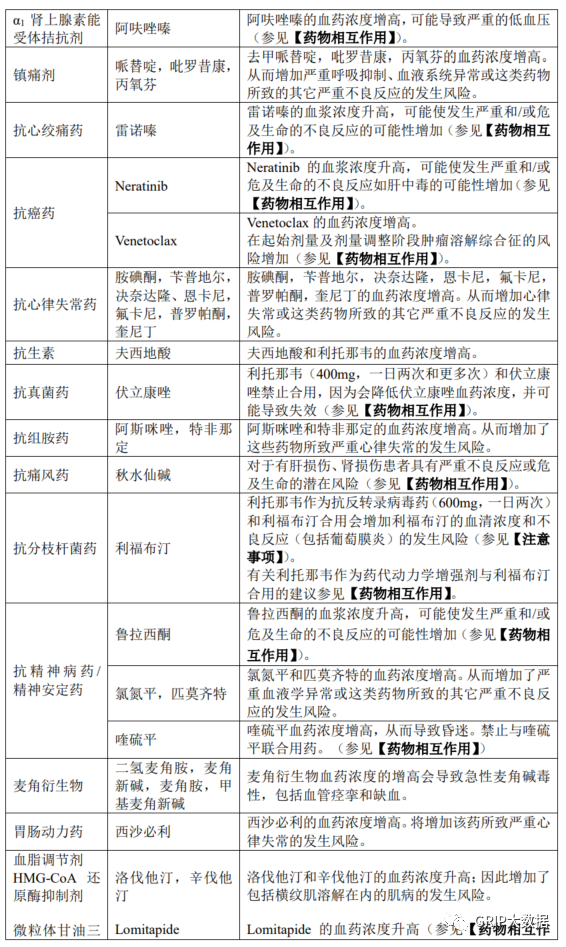
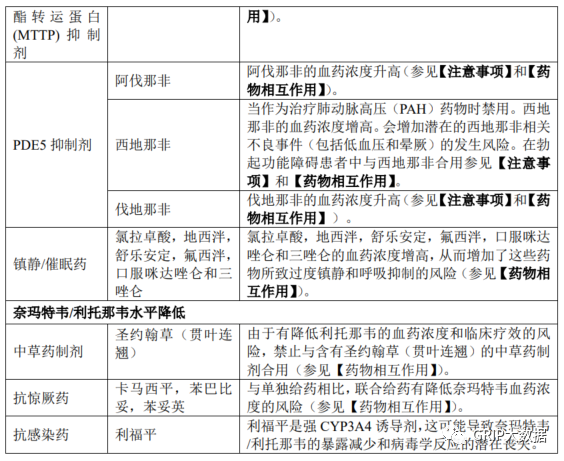
禁止联用产品
本品不得与高度依赖 CYP3A 进行清除且其血浆浓度升高会导致严重和/或危及生命的不良反应的药物联用。本品不得与强效 CYP3A 诱导剂联用,否则会显著降低奈玛特韦/利托那韦血浆浓度,可能导致病毒学应答丧失和潜在耐药性。鉴于 CYP3A 诱导剂停用后的延迟效应,即使最近停用了列在下表中的药物,也不能立即开始本品治疗。

临床试验数据
本品在经实验室确诊感染 SARS-CoV-2 的非住院、有症状的成人受试者中开展了一项II/III 期、随机、双盲、安慰剂对照研究(EPIC-HR 研究)。该研究纳入受试者为年龄≥18 岁,且至少有以下一种进展为重症的高风险因素:糖尿病、超重(BMI>25)、慢性肺病(包括哮喘)、慢性肾脏疾病、目前吸烟者、免疫抑制疾病或免疫抑制治疗、心血管疾病、高血压、镰状细胞病、神经发育性疾病、活动性癌症、需要相关医疗性支持、或 60 岁及以上(不考虑合并疾病)。COVID-19 症状发作≤5 天的受试者被纳入研究。研究排除了既往有 COVID-19 感染或 COVID-19 疫苗接种史的患者。
受试者随机(1:1)接受本品(奈玛特韦 300 mg/利托那韦 100 mg)或安慰剂口服给药,每 12 小时一次,持续 5 天。主要疗效指标是截至第 28 天内发生 COVID-19 相关住院或任何原因死亡的受试者比例。在改良意向性治疗(mITT)分析集 [症状发作≤3 天内接受治疗且基线时未接受或预期不会接受 COVID-19 治疗性单克隆抗体(mAb)治疗的所有受试者]、mITT1分析集(症状发作≤5 天内接受治疗且基线时未接受或预期不会接受 COVID-19 治疗性 mAb治疗的所有受试者)和 mITT2 分析集(症状发作≤5 天内接受治疗的所有受试者)中对主要疗效指标进行了分析。
共有 2,246 例受试者被随机至本品或安慰剂。基线时,平均年龄为 46 岁,其中 13%的受试者为 65 岁及以上(3%为 75 岁及以上);51%为男性;72% 为白人,5%为黑人,14%为亚裔;45%为西班牙裔或拉丁美洲裔;66%的受试者在症状出现≤3 天内开始研究治疗;81%的受试者体重指数[BMI]≥25 kg/m2(37% BMI≥30 kg/m2);12%患有糖尿病;不到 1%的研究人群有免疫缺陷;47%的受试者在基线时血清检查显示阴性,51%血清检查显示阳性。平均(标准差)基线病毒载量为 4.63 log10 拷贝/mL(2.87);26%的受试者的基线病毒载量 >107(拷贝/mL);6.2%的受试者在随机化时已接受或预期会接受 COVID-19 治疗性 mAb 治疗,故被排除出 mITT 和 mITT1 分析集。两个治疗组中的主要 SARS-CoV-2 变异株为 Delta 株,多数为亚型 21J。
本品组和安慰剂组之间的基线人口统计学和疾病特征分布均衡。mITT1 分析人群的主要疗效指标结果见表 4。对于主要疗效指标,mITT1 分析人群中截至第 28 天 COVID-19 相关住院或任何原因死亡的发生率,试验组和安慰剂组分别为 0.8%(8/1039)和 6.3%(66/1046)。

在 mITT 和 mITT2 分析人群中观察到一致的结果。mITT 分析人群共纳入 1,379 例受试者。其中,本品组的事件发生率为 0.72%(5/697),安慰剂组为 6.45%(44/682)。
在 mITT1 分析人群中,对从症状发生至开始接受治疗的天数(≤3 天,>3 天)、基线疾病严重程度(轻度、中度)、年龄(<65 岁、≥65 岁)、性别(男性、女性)、人种(白人、亚洲人、黑人或非洲裔、其他)、身体指数(BMI<25 kg /m2,BMI≥25 且<30 kg /m2,BMI≥30 kg /m2)、基线病毒载量(< 4 log10 拷贝/mL、≥ 4 log10 拷贝/mL;或< 7 log10 拷贝/mL、≥ 7 log10 拷贝/mL)、基线 SAR-CoV-2 血清学检测(阴性、阳性)、合并疾病数量(0-1、2-3、≥4)、基线合并疾病或状态[吸烟(是、否)、糖尿病(是、否)、免疫抑制性疾病或免疫抑制治疗(是、否)、慢性肺病(是、否)、高血压(是、否)、心血管疾病(是、否)、慢性肾脏疾病(是、否)、装置依赖(是、否)、HIV 感染(是、否)、镰状细胞病(是、否)、神经发育性疾病(是、否)、癌症(是、否)]等进行了亚组分析,在 mITT2 分析人群中对已接受/预期会接受 COVID-19mAb 治疗(是、否)进行了亚组分析。结果显示,除了事件数极少或因没有受试者发生事件而无法进行统计学检验的情况外,绝大多数亚组主要疗效的点估计值与总人群的主要疗效趋势相同。
在 mITT 分析人群中,在第 5 天时,本品治疗与安慰剂相比使鼻咽样本中病毒载量下降约 0.9 log10 拷贝/mL。在 mITT1 和 mITT2 分析人群中观察到相似的结果。
在 mITT 分析人群中,截至第 28 天达到所有目标体征/症状持续缓解的时间,试验组和安慰剂组分别为 12 天和 15 天;截至第 28 天达到所有目标体征/症状持续消退的时间,试验组和安慰剂组分别为 16 天和 18 天。在 mITT1 和 mITT2 分析人群中观察到相似的结果。
了解更多临床试验信息,欢迎登录grip以查询更多与疾病相关的临床试验。

“GRIP大数据”是普瑞纯证旗下针对医疗器械行业的产研动态、科技资讯、数据分析、数据研报和可视化成果的资讯服务发布窗口。旨在为医疗器械行业从业人员带来基于Saas和Data打开全新的视角。
穿越周期,医械世界,分析有我,数读有你。
更多医疗器械全周期Saas+Data解决方案,欢迎访问grip.purefda.com,快速注册点击下方“阅读原文”或扫描下方二维码。

