快讯 | FDA发布突破性设备最新进展:入围提速,上市仍很严格

当地时间7月12日,FDA发布了近期有关Breakthrough Devices Program(突破性医疗器械计划)产品的最新统计信息。
什么是突破性产品?
作为全球医疗器械产品创新的前沿阵地,美国一直鼓励创新产品的设计、研发与上市,作为监管当局的FDA也于2018年起设立了“突破性医疗器械计划”,用以鼓励创新医疗器械的发展,其范围覆盖了不同产品不同风险等级的各个上市前申请框架。
作为先前快速访问途径(EAP——Expedited Access Pathway)和优先审查(PR——Priority Review)的取代产物,“突破性医疗器械计划”可以明显缩短创新产品从研发到上市流通的时间周期。
除此之外,FDA于2021年设立了“医疗器械安全技术计划”(STEP),用于“突破性医疗器械计划”的补充,用以覆盖预期用途对应的疾病并不存在急迫需求的范围。
入选数量
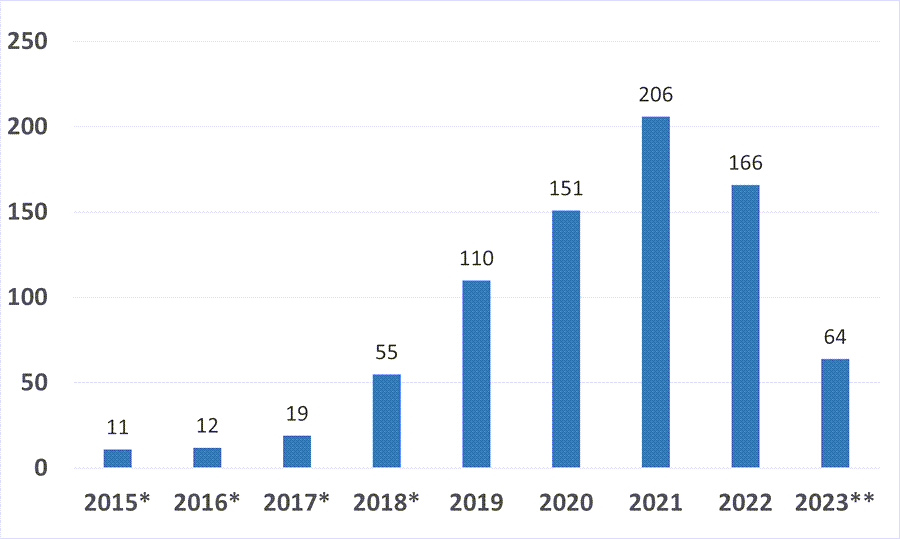
截止2023年3月31日,CDRH和CBER已授予了794款产品突破性医疗器械的称号(含原有EAP路径的产品)。下图为按照时间分列的授予数量:
而按照不同的医学分类领域,整体的被授予的分布如下,心血管(173)、神经领域(146)、骨科(92)、肠胃(63)分居前列,而此块也代表着医疗器械创新的主要阵地。

虽然以上共计794款产品被授予了相关称号,但截止到2023年3月31日,仅有67款产品获得了上市前许可,上市率不足8.1%。
而与CDRH上次更新的数据进行对比,从截止2022年12月31日的760款,4个月内新增了34款产品的入围,完成上市前申请的也由62款增加了5款产品。
他们分别是:
MASIMO CORPORATION旗下的MASIMO SAFETYNET OPIOID SYSTEM于2023年3月31日获批;
BIORETEC, LTD.旗下的REMEOS SCREW LAG SOLID于2023年3月29日获批;
REWALK ROBOTICS, LTD.旗下的REWALK P6.0于2023年3月2日获批;
ABBOTT LABORATORIES旗下的Traumatic brain injury (TBI) test于2023年3月2日获批;
REFLEXION MEDICAL, INC.旗下的REFLEXION MEDICAL RADIOTHERAPY SYSTEM (RMRS)于2023年2月1日获批;
随着国内医疗器械厂商在研发方面的持续投入,我们也看到了许多厂商在此块的尝试和探索,普瑞纯证作为国内医疗器械出海的最佳伙伴,如果您有此类需求,欢迎与我们销售顾问进行沟通,我们丰富的专家资源将为您设计最优的申报路径、协同官方策略和整体解决方案。

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化AI赋能生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,500万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
