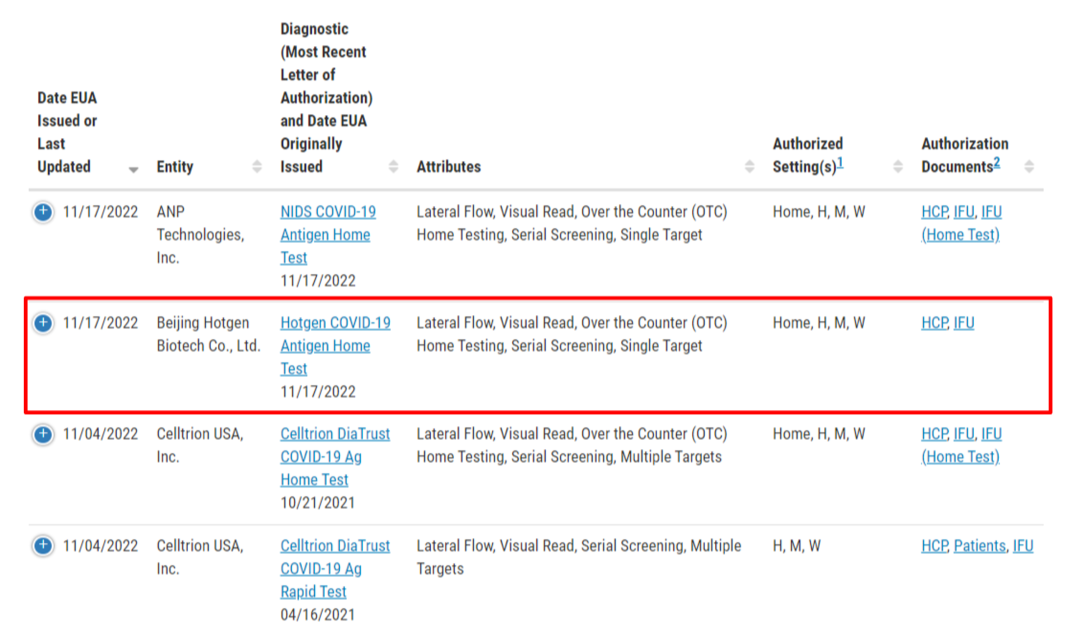
北京时间2022年11月18日下午,北京热景生物宣布其生产的新冠抗原自测试剂盒Hotgen™ COVID-19 Antigen Home Test获得美国食品药品监督管理局(FDA)的紧急使用授权(Emergency Use Authorization,EUA)。不久后,FDA网站上也正式释出了这一EUA的官方消息,让我们诚挚地祝贺热景生物在美国市场的布局再下一城!
细数起来,这是热景生物新冠抗原自测试剂继获得英国CTDA认证后,又一次获得的重大认证。至此,热景生物的新冠抗原自测试剂已经同时获得欧盟CE、英国CTDA和美国FDA EUA授权,几大重要海外市场的入场券稳稳在手!产品实力出众,市场眼光长远,着实让人佩服!美国当地时间11月15日,FDA批准了Roche的猴痘检测试剂盒cobas MPXV for use on the cobas 6800/8800 Systems (cobas MPXV) 的EUA,这也是美国正式开启猴痘检测EUA后,全球第三款获得FDA批准的猴痘检测产品。其他两款分别是9月份Quest Diagnostics公司被批准的产品Quest Diagnostics Monkeypox Virus Qualitative Real-Time PCR和10月份Abbott被批准的产品Alinity m MPXV。Roche获批的这款猴痘检测试剂盒可在 Cobas 6800/8800 系统上运行,用来定性检测人类病变拭子标本中猴痘病毒的 DNA,旨在用于中等和高度复杂的实验室,并授权其医疗保健提供者将其用于怀疑感染猴痘病毒的人。值得一提的是,普瑞纯证旗下的实验室里也配备了Cobas 6800全自动分子诊断系统,这套系统由样品导入,样品转移,样品分离提纯以及扩增检测仪四个模块组成,在8小时内可以分析最多384个样品,最快结果需要3个半小时。极大地保证了普瑞纯证临床试验服务的效率和质量!普瑞纯证,作为一家行业领先的全球化SaaS+Data生命科学服务商,我们拥有法规认证与临床经验丰富的全球顶尖专家服务团队,可提供新冠以及猴痘检测产品EUA申请的全流程咨询服务和海外临床试验等一站式解决方案!如有相关业务需求,欢迎您前来咨询!我们时刻准备着助力优秀的中国医疗器械和体外诊断产品破浪出海,期待会有更多的中国企业成功获得EUA批准!
普瑞纯证是行业领先的全球化 SaaS+Data 生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!