快讯 | MHRA计划2025年年中实施新立法,多类CE持证产品流通截止时间再度更新

当地时间6月14日,英国官方发布了“Medical Devices (Amendment) (Great Britain) Regulations 2023”法案更新内容,该法规将于7月1日全面生效(点击“阅读原文”以查看更多)。
该修正案作为解释性说明进一步指出,修正案的目的是“延长某些符合欧盟立法的医疗器械可在英国投放市场的期限”。
值得一提的是,自改革最初于 2021 年宣布以来,英国现在打算让他们未来的新立法从 2025 年 7 月 1 日开始实施——比之前提议的 2024 年夏季日期( 2022 年 10 月宣布)再度推迟一年。
法案修订后,对应的截止时间表信息整理如下:
带有CE标志的医疗器械产品
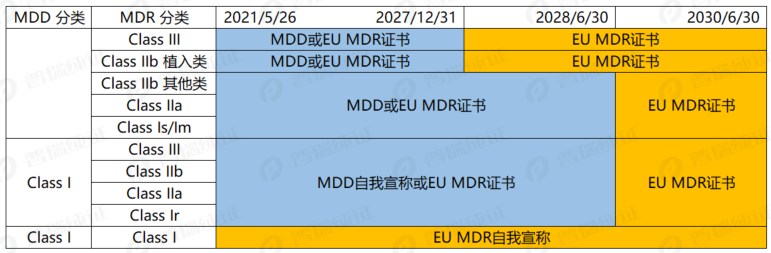
制造商可以利用公告机构颁发的MDD CE证书或MDR CE证书:
● 对于 III 类或 IIb 类植入式设备,截止日期为 2027 年 12 月 31 日;
● 对于 IIb 类、IIa 类、I 类无菌和 I 类测量设备,截止日期为2028年6月30日;
● 对于 MDD I 类自我宣传或升级至MDR的,截止日期为2028年6月30日;
所有分类产品的UKCA替换截止时间为2030年6月30日。
带有CE标志的IVD产品

制造商可以利用公告机构颁发的IVDD CE证书或符合 IVDR证书:
● List A、List B、Self-test 产品的IVDD CE证书,截止日期为2025年5月26日;
● 对于 IVDD 自我宣称或升级至IVDR的,截止日期为2030年6月30日;
所有分类产品的UKCA替换截止时间为2030年6月30日。
当前内容进行更新后, 相信您的产品在具体操作层面(例如2025年5月26日起可在英国市场流通)会有具体的疑问,欢迎与我们的销售顾问进行沟通以了解更多细节,制定出符合您企业路线的英国准入策略。
普瑞纯证全球顾问团队拥有获得全世界不同医疗器械市场监管审批手续的丰富经验,医疗器械产品进军全球市场,欢迎咨询。

了解更多:

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于
普瑞纯证是行业领先的全球化AI赋能生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
