专家观点 | FDA的三联检首批给了一家破产公司,它能涅槃重生嘛?

前情回顾
美国当地时间2月24日下午,美国食品药品监督管理局(FDA)授权首个可用于家庭检测流感和新冠病毒的非处方(OTC)自我诊断测试。Lucira COVID-19 & Flu Test是一种单次使用的家庭测试工具,可在约30分钟内提供通过自行采集鼻拭子样本的检测结果。此次授权为大众获得在家诊断测试提供了更多选择。FDA设备与放射卫生中心CDRH主任Jeff Shuren博士也给予了高度评价。

业界翘楚
那么,这位创造历史的Lucira Health公司是何方神圣呢?他们其实有过辉煌的历史,疫情刚刚开始的时候,首个获得FDA批准的家庭自测试剂盒也是Lucira出品的。
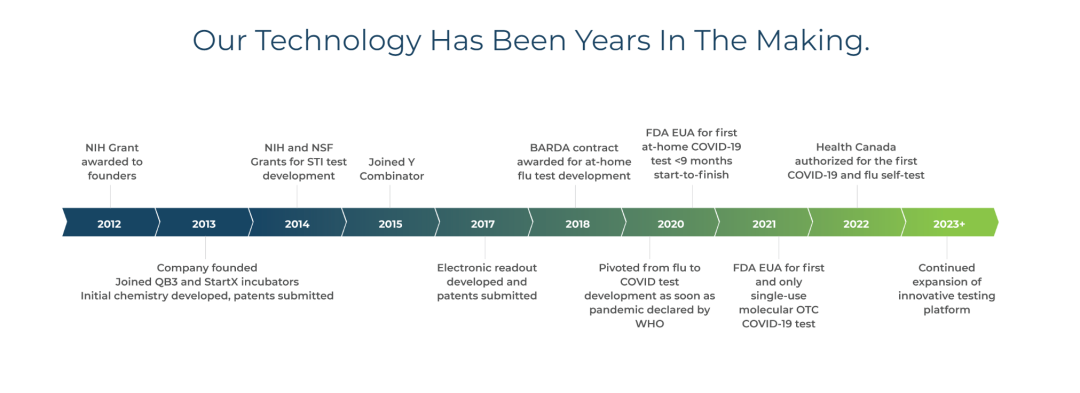
根据公开资料,Lucira Health是一家成立于2013年的医疗技术公司,专注于开发和商业化的传染病检测试剂盒。该公司于2020年11月推出了首个获得FDA批准的家庭自测试剂盒。
在新冠疫情世界范围内蔓延,新冠自测试剂盒需求激增的背景下,Lucira Health近期内获得了迅速发展,并于2021年2月上市。
回顾上市后的披露信息,除了2022年第一季度曾短暂地扭亏为盈,Lucira一直处于亏损中,最新一季度数据为2022年第三季度,营收规模为3439万美元,净亏损高达1.27亿美元。
错失流感季
据CDC最新数据,美国流感季节在去年冬初达到顶峰,但现在病例数逐步走低。
该机构估计本季度至少发生了 2500 万例流感病例,导致 28万余人住院和 近2万余人死亡。
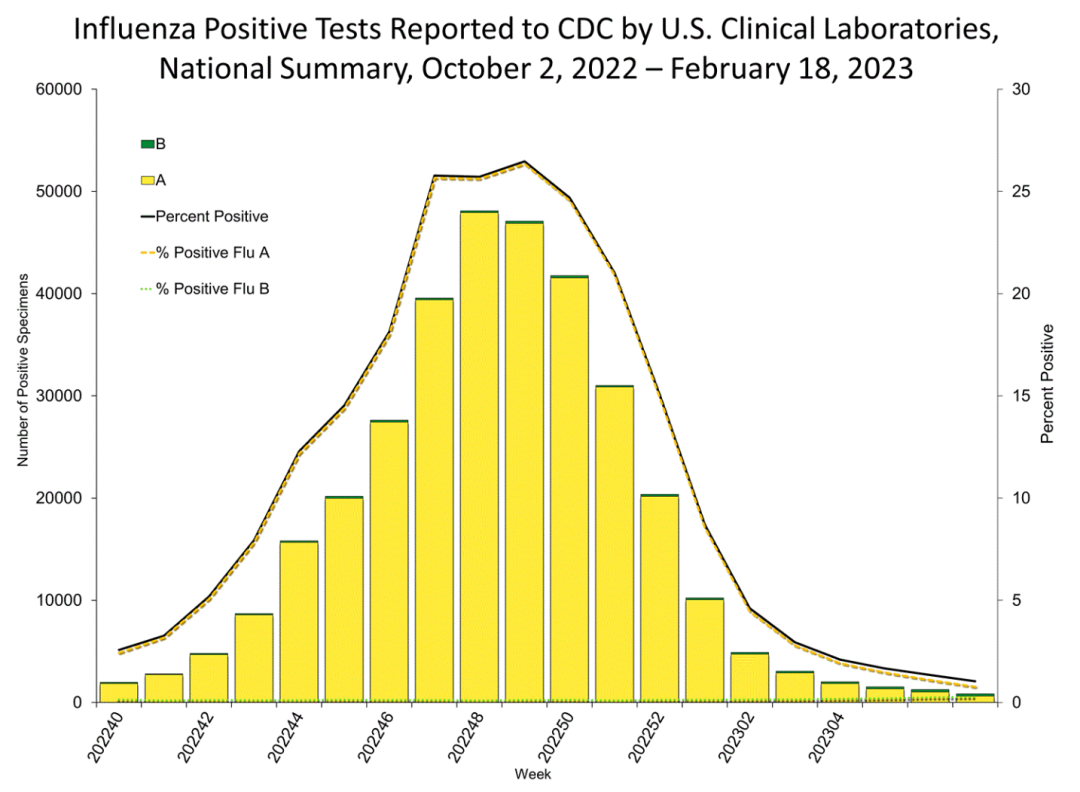
但每周仍有相当数量的 Covid-19 感染被记录在案:根据 CDC 的数据,截至 2 月 22 日结束的一周,记录了超过 23万余例病例和 2,400 余例死亡。
本周早些时候,Lucira Health 根据美国破产法第 11 章规定申请破产保护,并宣布将尝试出售其业务。
“公司预计 2022 年 8 月将针对 COVID-19 和流感测试的 OTC 获得 EUA,但 FDA 的批准过程变得冗长,导致在 2022-2023 年流感季节期间,三联检自测套件没有获得更多的财务收益, ” Lucira Health 在此前一份新闻稿中声明。
由于2022年全球多地疫情政策的优化,市场对新冠自测试类剂盒的需求有所下降,再加上为2022-2023年流感季节开发的自测试剂盒,监管审批速度低于预期,导致收入和资本化不足以抵消支出。
因此,为了自救, Lucira的董事会在去年10月批准了成本削减计划、裁员、调整供应商协议以及聘请咨询公司Armanino,寻求包括公司出售在内的战略选择。在一份提交给联邦法庭的声明中Armanino经理Alexander Brandtneris写道,Lucira和Armanino于12月13日开始推销公司的资产,但没有收到任何令人满意的公司或资产收购报价。
该公司在进行重组期间继续建立合作伙伴关系,于12月宣布与KSL Pulse Scientific合作在加拿大分销组合式COVID-19和流感检测产品。
并于1月5日宣布与远程医疗公司Sesame合作提供组合式COVID-19检测和治疗服务。
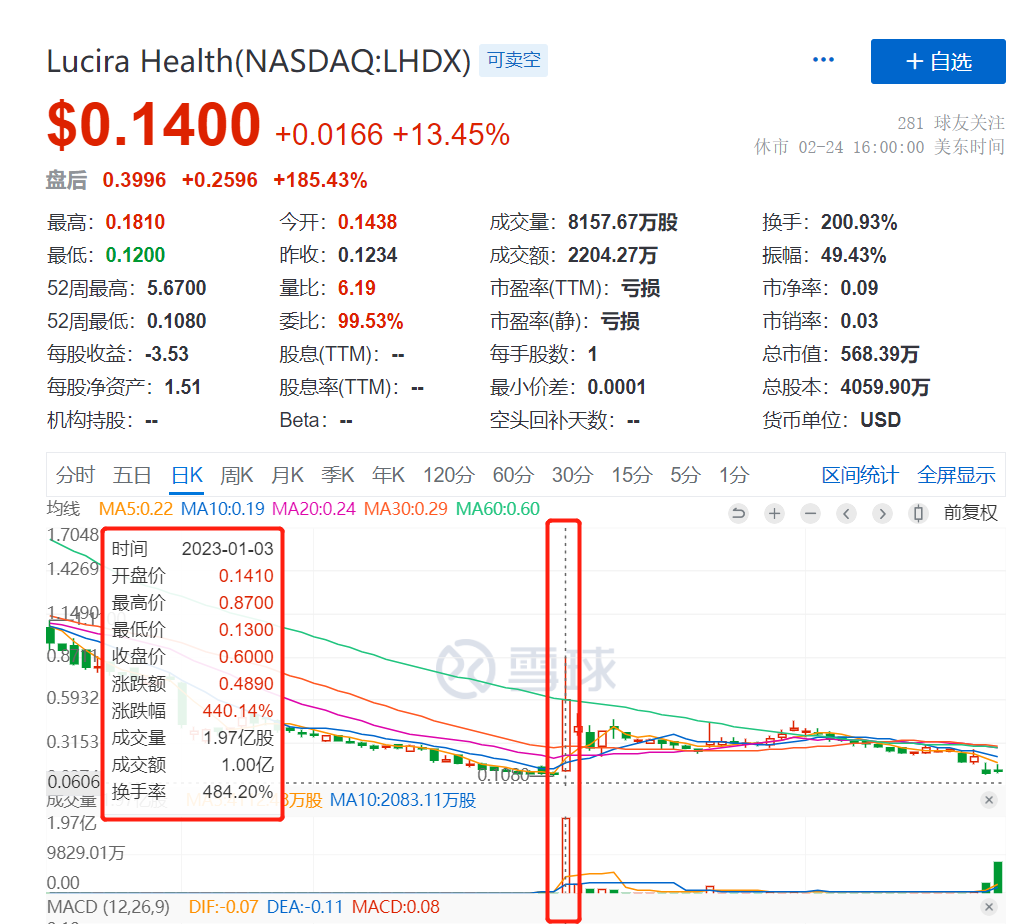
在消息披露前同样出现“惊人”的成交天量
FDA的新批准,无疑给Lucira注入了一剂强心针,也算是FDA对没有及时批准Lucira 三联检产品而完美错过流感季的一点补偿。
这次三联检获批的新闻一出,Lucira股票大涨13.45%,目前股价为0.14美元。盘后更是大涨185.43%,达到40美分一股。

为什么FDA还要批准他们的产品?是FDA不食人间烟火,还是FDA的独立性得以彰显?还是FDA雪中送炭,想帮助他们渡过难关 ?
Lucira Health 周五表示,它将在晚些时候回答投资者有关破产申请对测试推出时间的影响、当前制造生产能力或自测类价格的具体问题。我们也将密切关注此块进展。
后疫情和非流感季
根据普瑞纯证首席科学家王永强博士介绍,Lucira COVID-19 & Flu Home Test OTC 联检产品是基于等温扩增 (LAMP) 测定DNA方法建立的,比起胶体金纸条测定抗原方法而言,有耗材多、操作相对较复杂和价格高的缺点。
尽管此产品已经拿到了 FDA EUA授权,王博士并不认为此 OTC 产品在疫情接近尾声,流感季节也即将过去的当前能够得到广泛美国家庭的青睐和使用。
在大流行期间,一些公共卫生专家批评 FDA 在批准家庭自测产品方面进展缓慢,而联邦政府未能以很少或免费的方式让美国人更广泛地获得这些测试。即使居家检测获得批准,波动的需求也会促使制造商减产,导致病毒卷土重来时快速检测的短缺。
在大流行的头几年,流感活动异常低。但去年秋天,随着大多数流行病预防措施的取消,流感在流感季节的早期以惊人的数量重新出现。在过去的几个月里,美国人不得不应对多种病毒的浪潮,包括流感、冠状病毒和呼吸道合胞病毒 (RSV)。
但从审批监督机构FDA的角度看,就Lucira COVID-19 & Flu Home Test其产品应用的技术方法而言,FDA对分子诊断产品的家用化给与了积极肯定和认可。
而根据业内人士的反馈,Lucira的志向本不在新冠检测,而是更多的疾病检测。
成也萧何,败也萧何。新冠检测产品让他们迅速地发展并成功上市,然而市场对新冠需求的萎缩,这次的破产申请又可能会让他们走下神坛,离最初的目标越来越远。
所以您觉得Lucira Health 是回光返照,还是涅槃重生?
呼吸道病毒(Covid+FluA/B+RSV) 抗原四联检
新冠的居家检测已经让国内外民众养成了自我检测的习惯。新冠病毒变异株层出不穷,为疫情发展带来更多的不确定性。在流感季,新冠疫情与呼吸道传染病出现叠加流行的风险依然存在,进一步增加了防控工作的复杂性和难度。开发新冠、流感,RSV抗原联检技术,生产联检产品,符合当前疫情防控现状和需求,而在流感季节即将结束,为下一个窗口期做好准备,达到成本、收益预可控,已成为行业先行者的选择。美国、加拿大、澳大利亚等国均已针对呼吸道病毒联检产品发布了相应的指导文件,也足以说明这些国家政府对此类产品的重视。
1
产品介绍
Covid+FluA/B+RSV检测试剂盒基于侧流免疫层析测定,针对前鼻腔或鼻咽拭子样本进行新冠、甲流、乙流病毒的核苷酸抗原进行体外快速定性检测,检测对象为被医疗机构怀疑有符合COVID-19、甲型流感、乙型流感或呼吸道合胞病毒的呼吸道病毒感染的人。
2
法规形势
通过解读MDCG 2021-21, Common Specifications和FDA相关法规,我们分别整理了四联检检测试剂盒在欧洲获得CE证以及在美国获得510(k)认证需要做的测试项目:
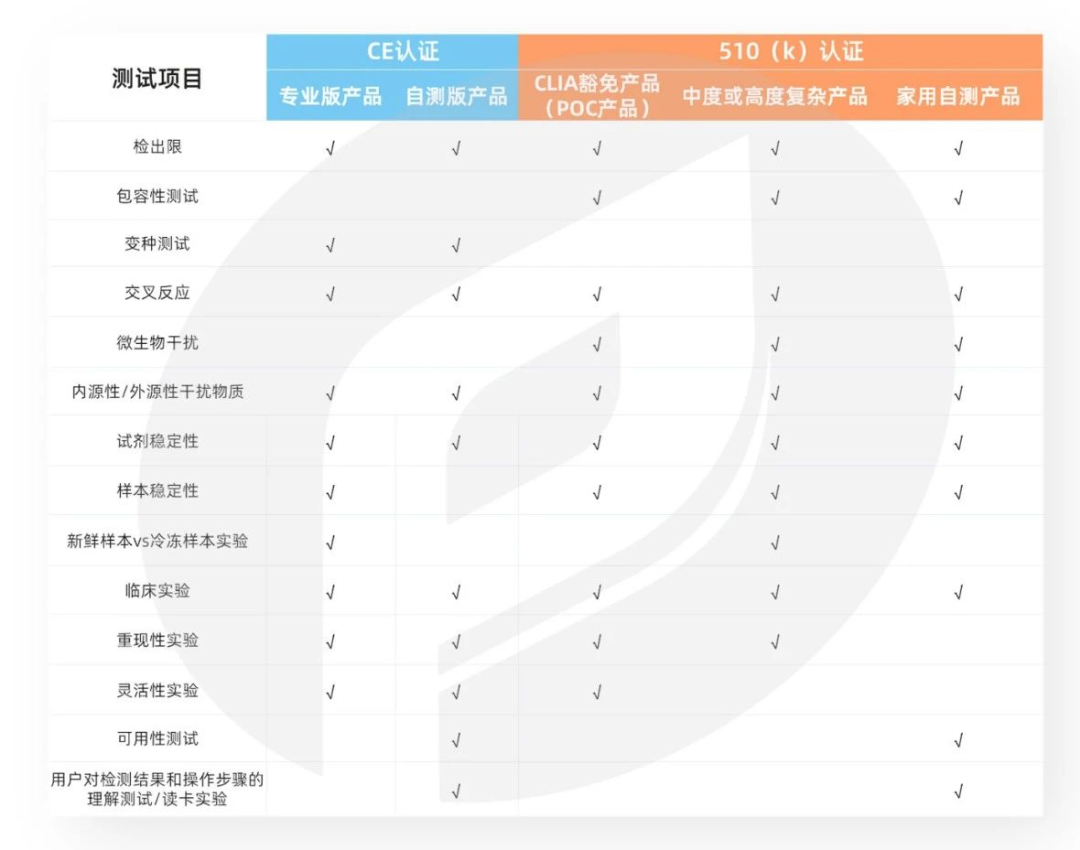
目前,全球Covid、FluA/B、RSV样本极度稀缺,加大了四联检产品各项测试的难度。普瑞纯证已在欧洲多个国家和美国布局建立生物银行(样本库),并与多家欧美临床试验机构达成合作,可承接四联检检测试剂的海外临床试验。
各国医药监管机构在临床试验的审核中经常会提出本地人群适用的问题,而且出于安全考虑生物样本的国际流通几乎不可能实现,因此临床验证常常成为检测试剂出海的大难题。由于拥有多家临床试验机构渠道资源,普瑞纯证克服了样本稀缺的棘手难题,可以为IVD企业提供方案制定、测试、注册等全流程的临床试验研究服务。
3
普瑞纯证的优势
普瑞纯证有强大的技术专家和法规专家团队,有完善的符合IVDR和FDA法规要求的实验方案。
普瑞纯证在全球多个欧美国家均有生物银行,存有Covid、FluA/B、RSV临床样本,涵盖多个样本类型。
普瑞纯证已与全球多家临床实验中心达成合作,能在短时间内对接到实验室资源启动实验。
普瑞纯证在四联检检测产品试验经验丰富,在临床试验均取得一定成果,已有项目正在稳步推进。

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化 SaaS+Data 生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
