深度解读 | MDCG 2020-16 欧盟IVD分类规则修订内容解析

北京时间2023年2月11日,欧洲医疗器械协调小组(MDCG)更新了IVDR法规 (EU) 2017/746下的体外诊断医疗器械分类规则指南文件MDCG 2020-16。
一分钟快速了解专家解读内容
整体解读
这次修订最主要的变化是增加了对伴随诊断产品的解释说明(分类规则3(f))。在原有的内容基础上,本次修订添加了伴随诊断产品必须与配套使用药物相关联的要求,与IVDR要求(附录1第三章)保持一致,伴随诊断产品必须在说明书中列出所配套使用药物的国际通用名(International Non-proprietary Name, INN),如可匹配多种药物使用,则需列出所有药物的INN。
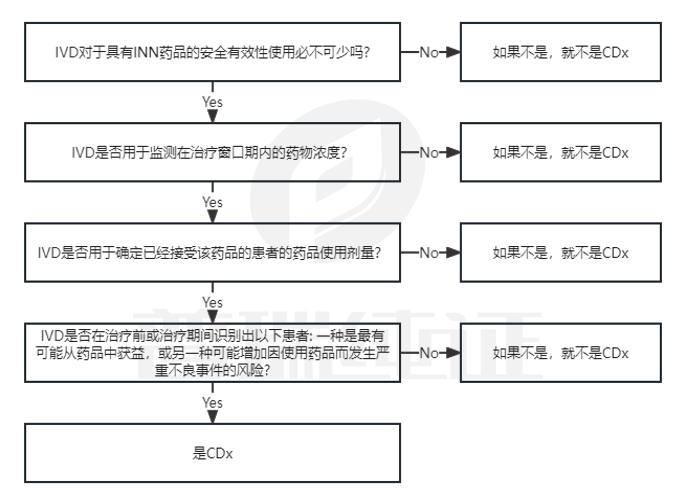
同时,本次修订还增加了伴随诊断产品的判断流程图(附录2),为公告机构和相关制造商在申请过程中进行产品分类提供指导,并对伴随诊断产品的定义做了进一步明确,增加了不属于伴随诊断IVD的产品举例。
随着科技水平的不断发展,伴随诊断试剂产品作为靶向治疗的重要辅助手段,必然会在注册审核中受到更多的关注,相关监管措施也会根据产品和市场情况益发完善。
调整明细
根据文件的历史修改记录,更新内容分别在Rule 1、Rule 2、Rule 3 和 Annex 2部分有所体现,具体调整如下:
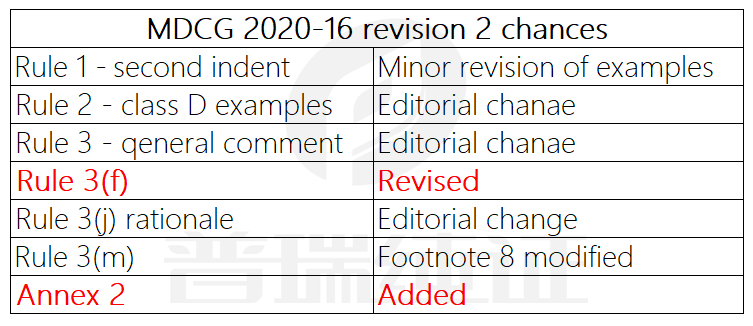
1.Rule 1 部分,针对大流行的结束,将 Highly virulent pandemic influenza virus 改成 highly virulent influenza virus 避免使用Pandemic一词,将更多的高毒性的病毒纳入范畴;
2.Rule 2 部分,将红细胞对照里面的Kpos 删除,改成KEL 1 , 并在ABO/Rh(D)后面增加Kell;

3.Rule 3 的概述部分,删去了之前分类中的模糊描述;

4.Rule 3(f) 部分,对于CDx的定义进行了补充说明:
a. 对CDx判断增加了限制条件就是结合的药物必须具有国际非专利名称或国际非专有药名(INN)。“如果要被定义为CDx, 该产品应该与具有国际非专利名称/国际非专有药名(INN)的医药产品有联系”,当然,该产品也必须能够有效甄别判定,使用该药品治疗的病人是否会给病人带来好处或增加的风险。
b. 用于监测医药产品的治疗,以确保相关物质在人体内的浓度在规定范围内的设备不被认为是CDx。举例了不属于CDx的检测药品治疗的器械,“比如说,用于血糖检测的设备,用于测量血液中环孢素浓度的设备,以及用于测量医药产品代谢物的设备“
c. 确认如果只是对特定标记物进行定量或定性确认的设备,目的是确认符合病人接受该药品的剂量,这些不被视为CDx,并举例说,“例如,用于测量肌酐浓度的设备可用于估计肾脏功能,以确定具有肾脏排除功能的医药产品的最佳剂量。另一个例子是识别病人的CYP2D6或CYP2C19基因型,以确定已经开出的药物的适当剂量“ 这些都不属于CDx。
5.Rule 3(j) 的合理性解释部分 ,将intended to be used,改成了 intended by the manufacturer. 更多从厂家的设计出发,而不是基于使用者的自我理解。

6.Rule 3(m)的备注中删除了部分英国政府网页的链接;
7. 针对Annex 2 列出了清晰的判断流程图:
以上就是对本次更新的全部内容解读,更多关于对MDCG 2020-16的详细内容或全球法规实时更新内容,请点击下方小程序进行访问。
如有疑问欢迎在我们的后台留言或扫描下方二维码联系我们的专家顾问团队咨询详情。

-普瑞纯证官方咨询顾问-
-获取 最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化 SaaS+Data 生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
