知识共享 I 临床试验与真实世界数据结合是医疗器械产品开发的大势所趋

医疗器械和诊断产品制造商面临着来自监管机构、支付方和供应商越来越大的压力,要求他们提供更全面的证据来证明其产品的有效性、安全性和成本效益。

为了满足这些日益增长的要求,同时加快研究进度和减轻临床试验负担,医疗器械厂家正在寻求创新的解决方案。将临床试验与真实世界数据(RWD)联系起来是一种有效的方法,可以在试验期间和试验之后捕捉所需的信息并加强临床证据的生成。
01
监管机构鼓励使用真实世界数据
为审批和市场准入决策提供依据
长期以来,医疗器械制造商一直依赖真实世界证据(RWE)来提交监管申请,而近期全球监管机构的指导意见正在加快 RWD 和 RWE 在临床和器械开发中的应用。美国监管机构推动使用 RWD 的工作始于 2016 年,当时《21 世纪治愈法案》(21st Century Cures Act)要求 FDA 制定在医疗器械证据提交中使用 RWD 的指南。目前,RWE 在临床开发中十分普遍。
-截至 2021 年年中,在美国所有获批的新药申请和生物许可申请中,96% 都使用了 RWE。
对RWD 和 RWE接受度的提高,为在医疗器械研究中使用 RWD 提供了投资和监管支持。这方面的例子包括:
1. 加速投资:FDA 建立了国家健康技术评估系统 (NEST),这是一项政府和民间合作项目,旨在通过链接和综合不同来源的数据,减少生成临床证据的时间和成本,从而支持医疗器械的监管审批和上市后监测。
2. 监管支持: 为了证明 RWE 的价值,FDA 的器械和放射卫生中心 (CDRH) 最近公布了 90 个成功将 RWD 纳入 2012 年至 2019 年监管报批的实例。其中 13 个例子概述了注册数据与行销数据的联系,例如来自医疗保险和医疗补助服务中心(CMS)的数据。
3. 将临床试验与 RWD 联系起来:在患者层面将临床试验数据与 RWD 联系起来,有助于医疗器械制造商比以往任何时候都更深入地了解患者的整体治疗过程。
监管机构热衷于将临床试验与 RWD 联系起来,以减少洞察力和证据方面的差距。美国食品和药物管理局局长罗伯特-卡利夫博士在 2023 年摩根大通医疗保健会议上说:"不难想象,与其让病人每三个月去一次研究诊所,然后研究协调员试图弄清楚这三个月期间发生了什么相比,不如把病人的医疗记录与在家中使用数字技术相结合,这样才能更好地描绘出一个人的情况"。
02
申办者正在通过至少五种方式从
关联的临床试验数据和真实世界
数据中释放价值
1. 以最小的负担进行纵向随访: 批准后的监测对于全面了解医疗器械的长期有效性和安全性至关重要。然而,临床试验的高成本和高负担给医疗器械制造商充分满足长期跟踪的监管要求带来了巨大挑战。将试验患者与 RWD 联系起来,即使在试验完成后,申办者也能被动地监测试验的有效性和安全性结果,从而减轻患者和研究机构的负担。考虑到许多临床疗效和安全性信号都是在上市多年后才出现的,因此这种能力对于诊断和器械试验尤为重要。
2. 为失去随访机会的患者提供证据:失去随访机会的患者可能导致试验无法达到监管审批所需的统计学意义。缺乏对患者疗效的深入了解,尤其是当治疗组之间的自然减员率不同时,也会导致偏差并损害研究结果的有效性。在患者层面将临床试验参与者与他们的 RWD 联系起来,有助于研究人员捕捉生存期、疾病进展和治疗路径变化等关键结果,或了解失去随访的根本原因。
3. 在实用性试验中验证和校准实际临床研究终点: 为确保使用 RWD 进行的实用性研究符合监管标准,申办者需要降低潜在的数据质量风险,从而减少 RWD 研究中可能出现的偏差。例如,为了了解临床试验与真实世界观察之间的差异,研究者可以利用患者层面的联系,对照基于试验的裁定结果来验证基于 RWD 的终点,并改进 RWD 中使用的测量算法。这将增强人们对实用性研究设计的信心,因为实用性研究设计依靠 RWD 作为一种更快、成本更低的证据生成方法。
4. 测量医疗资源利用率 (HCRU): 由于患者和研究场所的负担等实际限制,医疗器械制造商很少能在试验期间收集 HCRU 和成本数据。尽管这些终点的测量对于承保决策和支付方谈判至关重要,但在商业化之后,需要等待数年才能积累足够的实际证据。通过将临床试验与 RWD(如保险理赔和支付数据)联系起来,制造商可以加快生成其产品的 HCRU、成本和成本效益证据的时间。
5. 实现适应性试验设计和试验数据的再利用: 医疗器械制造商在设计临床试验时,会在选定的患者群体中评估预先指定的结果。然而,在产品上市后,厂家往往需要根据早期临床结果或医生在实施过程中的经验来改变程序或设计,从而偏离最初的试验方案。临床试验数据链接可以使研究人员重新使用试验数据,深入了解更多的结果和变量,而不增加患者主动收集数据的负担,从而提高研究人员适应这些变化的灵活性。
将医疗器械和诊断试验与 RWD 相连接,可以大大提高证据生成的深度和效率,也是业内越来越多采用的一种技术。为避免错失良机,需要在试验设计和实施过程中尽早植入获取患者同意书等基本数据元素。
医疗器械和诊断产品制造商现在就需要在临床试验规划中建立数据链接,以消除孤岛并有效利用数据源,从而在未来更好地生成临床证据。

普瑞纯证临床资源
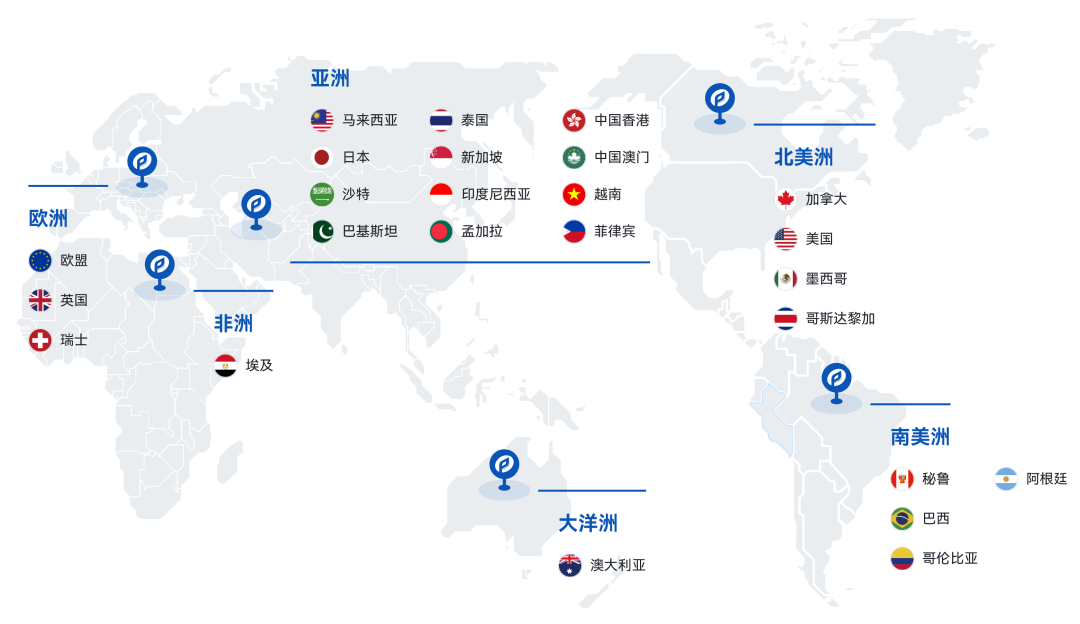
普瑞纯证(Pure Global)拥有遍布全球的全资当地代表子公司、多家自营临床实验室、注册生物样本库,强大的服务网络覆盖美国、欧洲、拉美、东南亚、中东及“一带一路”等25+全球主要医疗器械(MD)、体外诊断(IVD)市场。我们凭借经验丰富的国际化RA/QA/QC团队、独特的双博士双PM项目管理制度,以一站式服务为特色,成立至今已服务近千家客户,是行业内众多头部企业的合作伙伴。

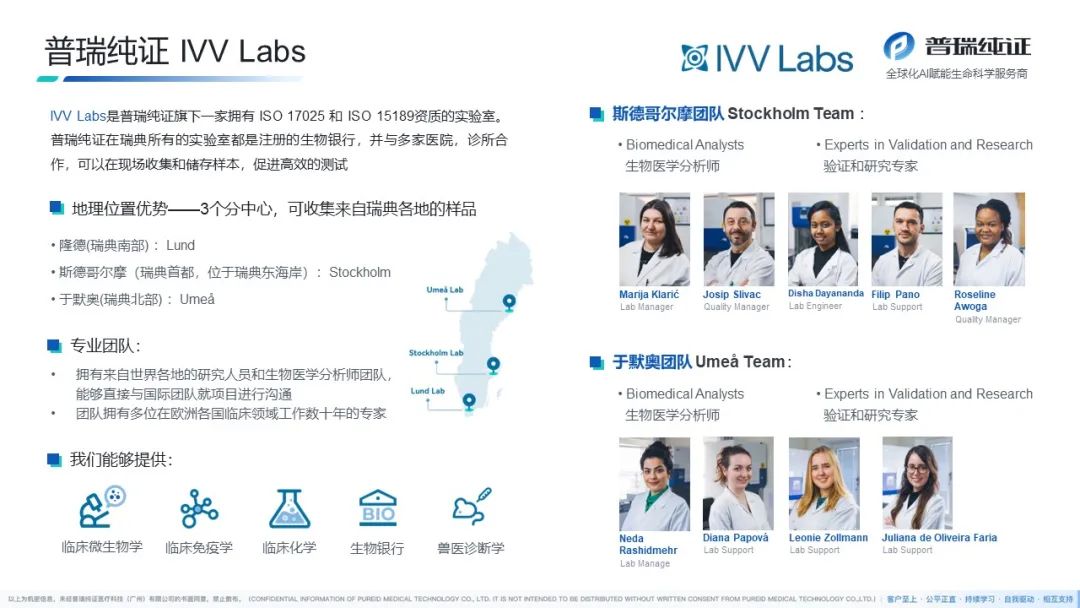

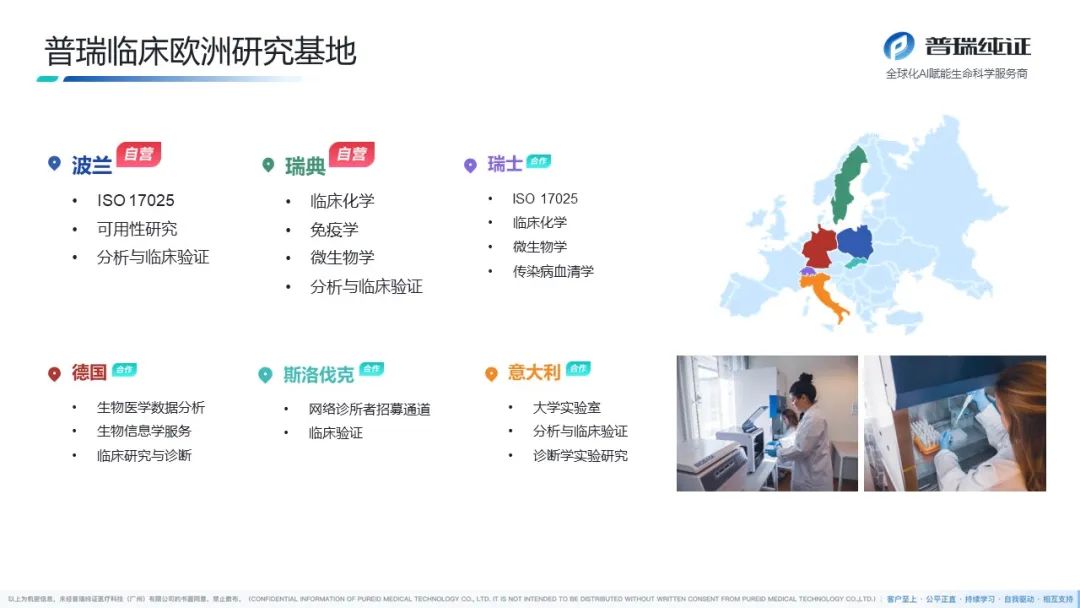

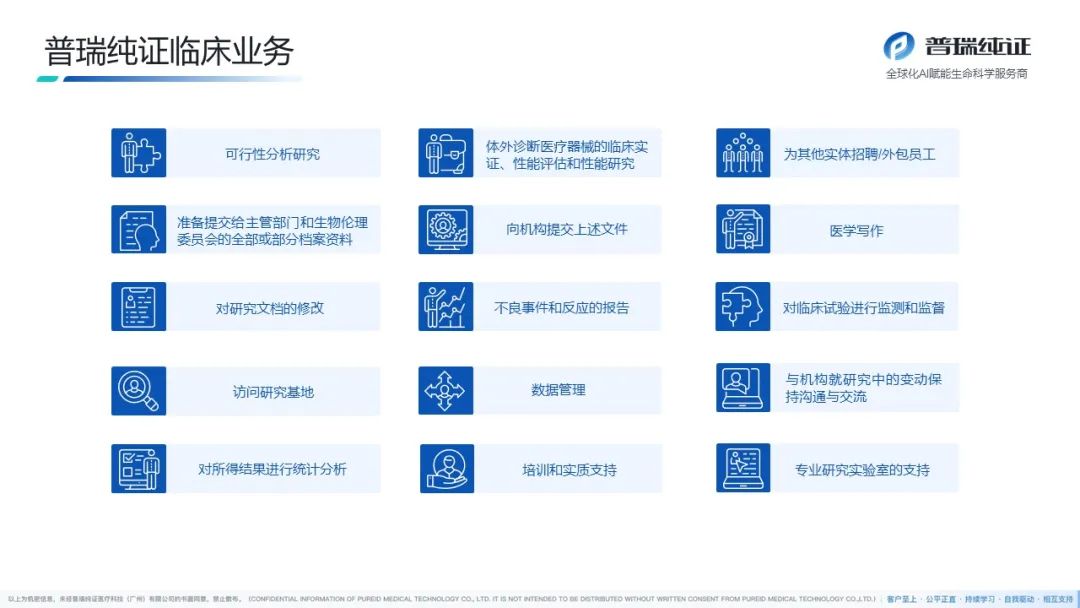
普瑞纯证 全球布局单元