GRIP大数据月报 | FDA 5月注册产品信息盘点及DeNovo产品信息概览

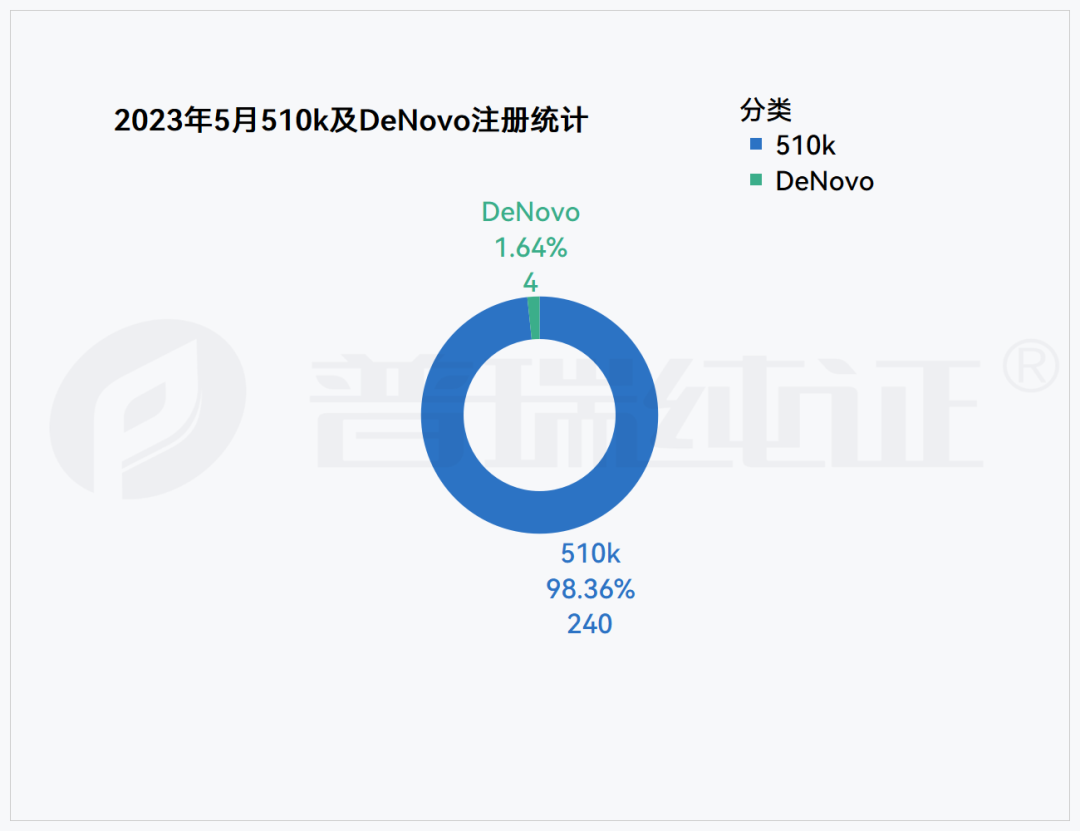
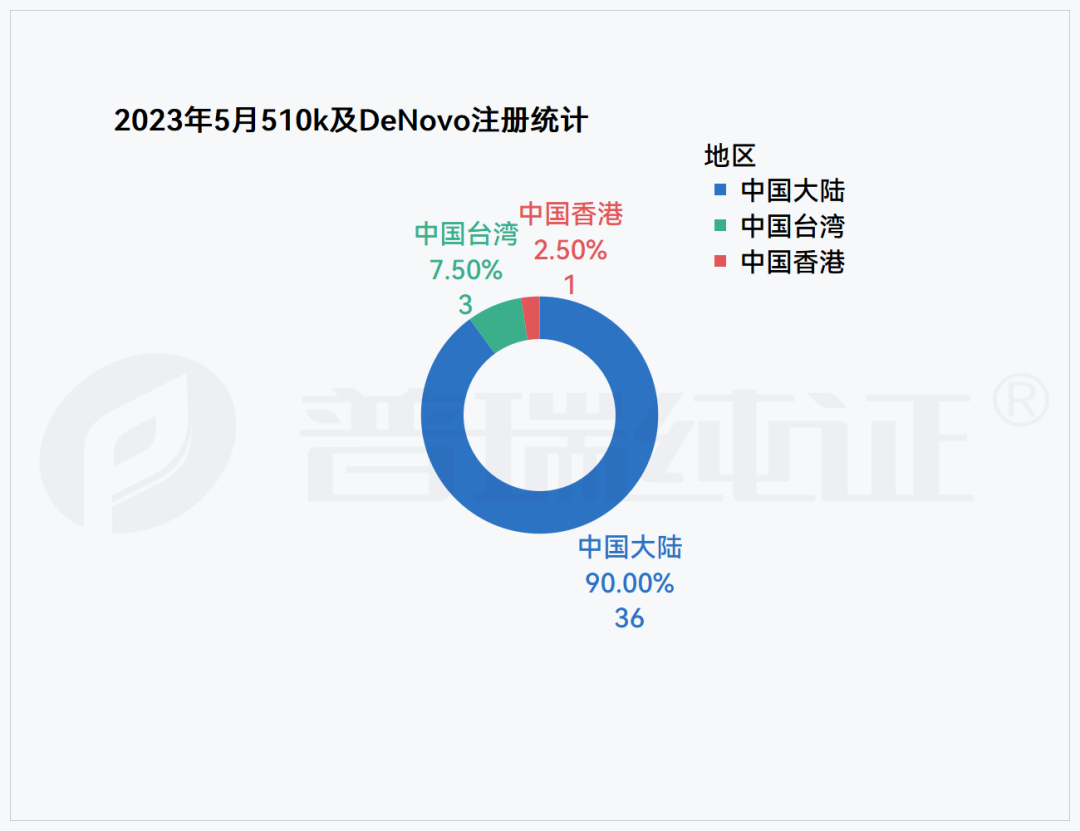
根据普瑞纯证GRIP大数据跟踪,FDA 于5月总计批准了244款医疗器械产品注册,240款510(K),4款DeNovo,其中中国厂商40款,全部集中在510(K)。
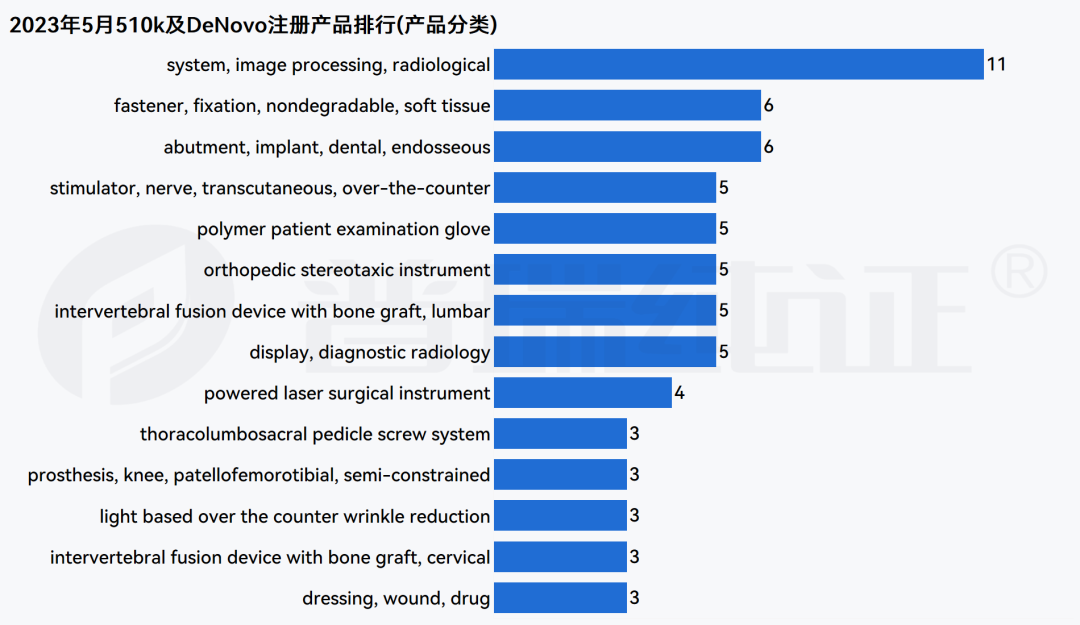
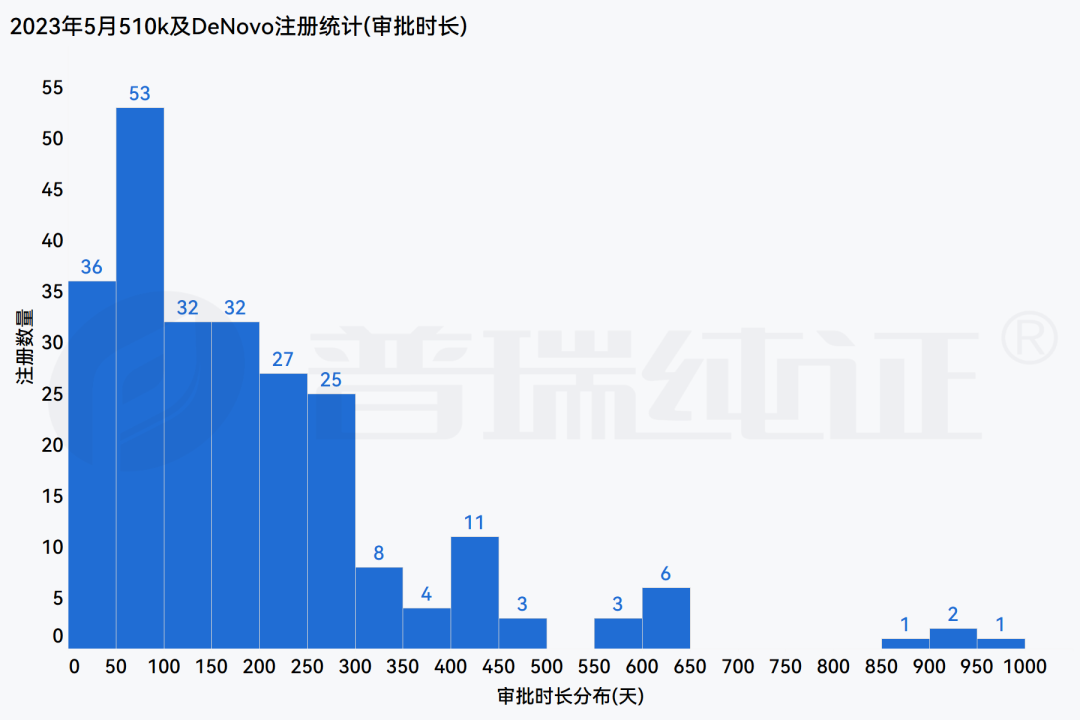
注册数量分布、注册时长分布及Product Code分布信息可查阅下方多图,更多法规、临床试验板块内容敬请关注后续更新的 《普瑞纯证&探针资本医疗器械行业月报5月版》内容。
左右滑动查看更多
在244款产品中,4款DeNovo产品的审批通过信息,
● 由BRAHMS GmbH, Part of Thermo Fisher Scientific 申请的产品 BRAHMS sFlt-1/ PlGF KRYPTOR Test System ;
● 由Swing Therapeutics, Inc. 申请的产品 Stanza ;
● 由Ortho-Clinical Diagnostics, Inc. 申请的产品 VITROS Immunodiagnostic Products Anti-SARS-CoV-2 IgG Reagent Pack, VITROS Immunodiagnostic Products Anti-SARS-CoV-2 IgG Calibrator ;
● 由Ortho-Clinical Diagnostics, Inc. 申请的产品 VITROS Immunodiagnostic Products Anti-SARS-CoV-2 Total Reagent Pack, VITROS Immunodiagnostic Products Anti-SARS-CoV-2 Total Calibrators ;
下面我们将依托GRIP数据对这四款产品进行一些信息的汇总。
BRAHMS sFlt-1/ PlGF KRYPTOR Test System
由BRAHMS GmbH, Part of Thermo Fisher Scientific 申请的产品 B·R·A·H·M·S sFlt-1/ PlGF KRYPTOR Test System在2022年05月02日开始提交产品申报材料后,历时381天,完成产品的DeNovo注册,Product Code:QWH。
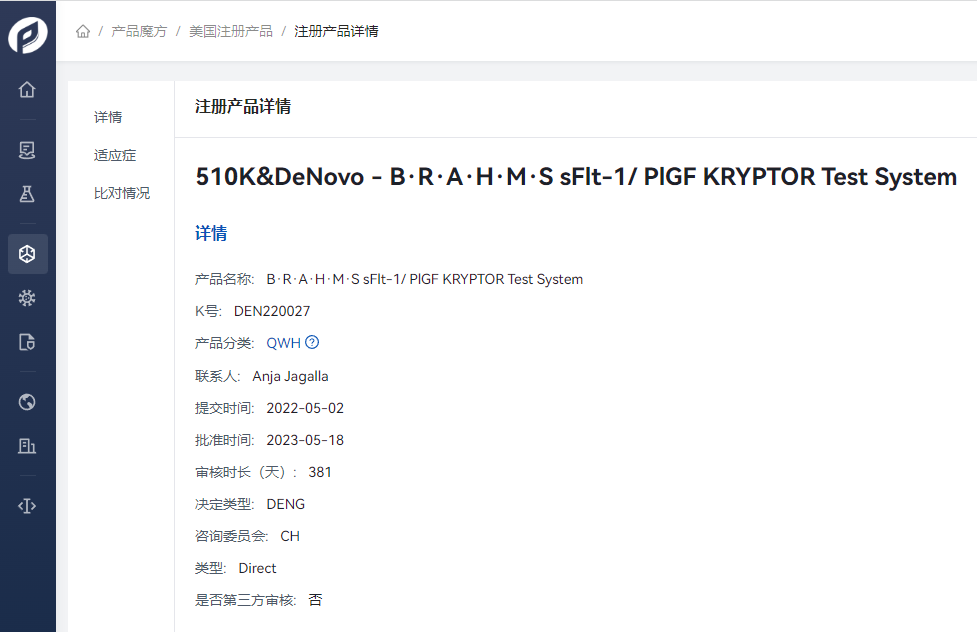
2023年5月18日,FDA授予B·R·A·H·M·S sFlt-1/ PlGF KRYPTOR测试系统(BRAHMS GmbH,Thermo Fisher Scientific的一部分)的上市许可,用于帮助评估某些因高血压紊乱(子痫前期、原发性高血压伴或不伴继发性子痫前期或妊娠高血压)住院的孕妇发展为伴有严重特征的子痫前期的风险。该测试系统是一种自动免疫荧光测试,使用增强的加里帕酰胺发光(TRACE)技术定量检测人血清和血浆中的胎盘生物标记物胎盘生长因子(PlGF)和可溶性Fms样酪氨酸激酶-1(sFlt-1)。
B·R·A·H·M·S sFlt-1/ PlGF KRYPTOR测试系统与其他实验室测试和临床评估相结合使用,用于帮助评估孕妇在就诊后2周内发展为伴有严重特征的子痫前期(根据美国妇产科医生学会指南定义)的风险。
B·R·A·H·M·S sFlt-1/ PlGF KRYPTOR测试系统获得了FDA突破性医疗器械的指定,是第一款获得上市许可以帮助预测有严重特征的子痫前期产妇预后的医疗器械。
根据CDC的数据,子痫前期是导致母体发病率的主要原因之一,估计在所有妊娠的3%至7%中发生。子痫前期的特征是高血压和肝脏或肾脏损伤的迹象,通常在妊娠20周后出现。每年,子痫前期导致全世界超过70,000例产妇死亡和50万例胎儿死亡。
Stanza
由Swing Therapeutics, Inc. 申请的产品 Stanza,在2022年11月21日开始提交产品申报材料后,历时169天,完成产品的DeNovo注册,Product Code:QWI。
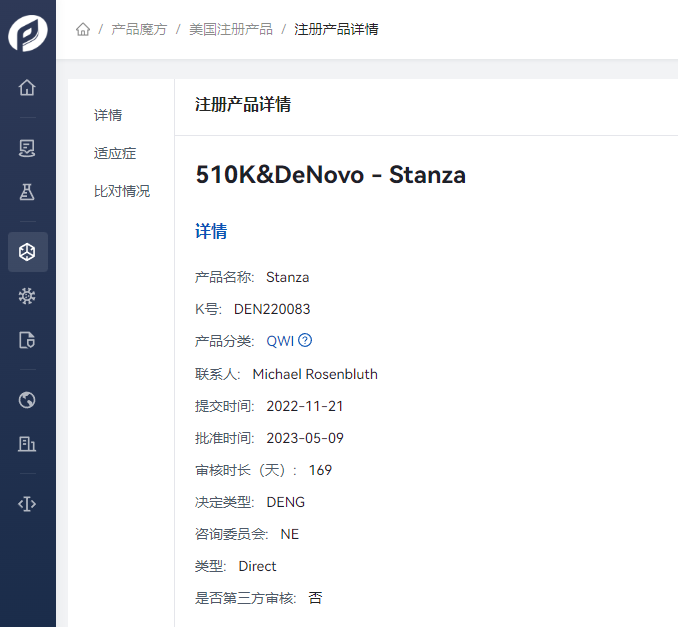
Stanza是一个基于智能手机的处方数字治疗产品(PDT),通过12周的自我指导方案提供行为认知疗法(ACT)治疗纤维肌痛症状。

多项随机对照试验显示ACT能显著减轻纤维肌痛的严重度。在FDA授予Stanza DeNovo资格之前,该公司进行了多项随机对照试验和实际研究,包括PROSPER-FM,这是有史以来最大的用于纤维肌痛治疗的设备试验,73%的患者在计划结束时纤维肌痛症状显著改善(由患者整体印象量表测量)。
Ortho-Clinical Diagnostics, Inc
由Ortho-Clinical Diagnostics, Inc. 申请的两种检测新冠病毒抗体的试剂盒:
1. VITROS Immunodiagnostic Products Anti-SARS-CoV-2 IgG Reagent Pack,VITROS Immunodiagnostic Products Anti-SARS-CoV-2 IgG Calibrator专门检测新冠病毒的IgG抗体,主要用于判断个体是否曾感染新冠病毒。2021年09月20日开始提交产品申报材料后,历时592天,完成产品的DeNovo注册,Product Code:QVP。

2. VITROS Immunodiagnostic Products Anti-SARS-CoV-2 Total Reagent Pack,VITROS Immunodiagnostic Products Anti-SARS-CoV-2 Total Calibrators检测新冠病毒的总抗体,包括IgG和IgM抗体,可以判断个体是否正在感染或曾感染新冠病毒。2021年09月21日开始提交产品申报材料后,历时591天,完成产品的DeNovo注册,Product Code:QVP。
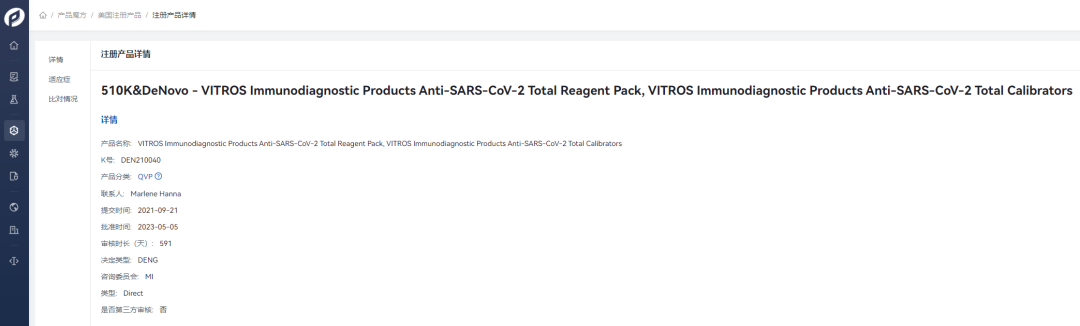
2023年5月5日,FDA授予VITROS Immunodiagnostic Products Anti-SARS-CoV-2 IgG Reagent Pack,VITROS Immunodiagnostic Products Anti-SARS-CoV-2 IgG Calibrator以及VITROS Immunodiagnostic Products Anti-SARS-CoV-2 Total Reagent Pack,VITROS Immunodiagnostic Products Anti-SARS-CoV-2 Total Calibrator的市场授权,这两种产品均由Ortho-Clinical Diagnostics公司生产。
这些检测仅供处方使用,用于定性检测人血清和血浆样本中SARS-CoV-2 IgG抗体,这些样本是在症状开始后15天或15天后收集的,旨在帮助识别最近或先前感染SARS-CoV-2的个体,其具有适应性免疫反应。血清学测试检测SARS-CoV-2抗体的存在,而不检测病毒本身。这就是血清学测试不应用于诊断或排除急性COVID-19感染的原因之一。早期感染的测试敏感性未知。阴性结果并不意味着被测试的个体不存在急性SARS-CoV-2感染。如果怀疑急性感染,需要进行诊断测试,如COVID-19的PCR或抗原测试。血清学测试通过检测SARS-CoV-2抗体来判断个体是否曾感染新冠病毒或接种新冠疫苗。阴性结果无法完全排除感染或疫苗接种的可能性,需要结合临床表现等判断。如果怀疑正在感染,应进行病毒核酸测试等确诊。血清学测试可用于了解社区内新冠病毒感染规模,为疫苗效果评价、群体免疫状况判断等提供依据。但其结果易受许多因素影响,临床应用需要慎重。FDA授权上述两种检测试剂盒对新冠病毒抗体进行检测,可用于帮助判断个体是否感染新冠病毒,为疫情监测和研究提供支持。但其结果解释应慎重,无法完全代替核酸检测。

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化AI赋能生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!