胡心洁:医疗器械注册转化之监管之路(上)

医疗器械 | 出口 | 认证|FDA CE | 行业热点 | 全球业务



01
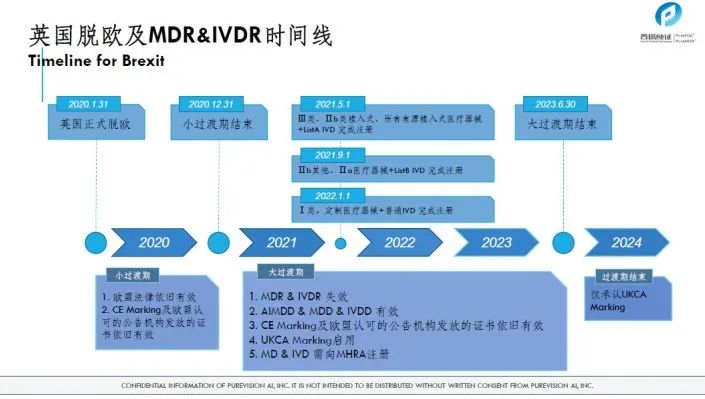
欧盟从MDD过渡到MDR的监管之路解析







02
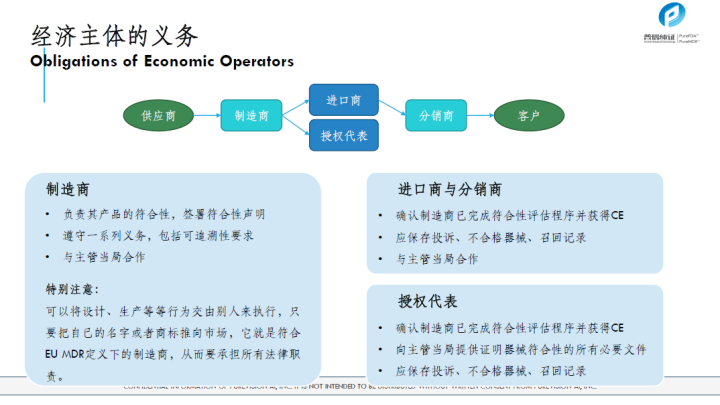
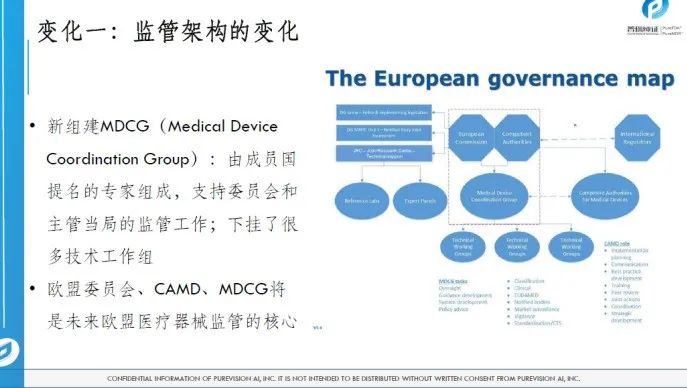
从MDD到MDR的主要变化及影响





03
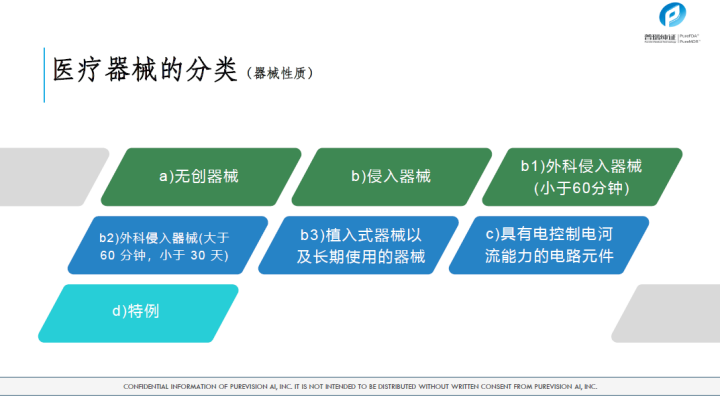
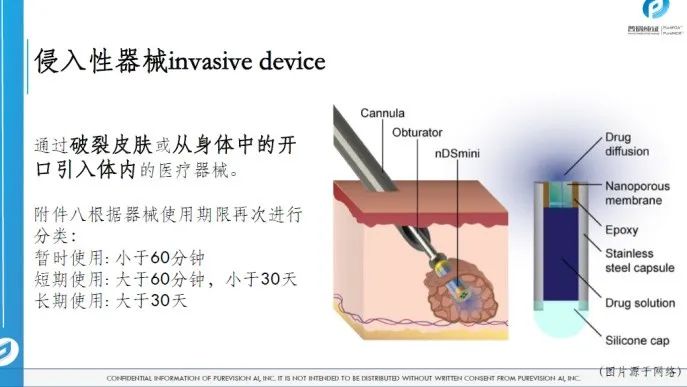
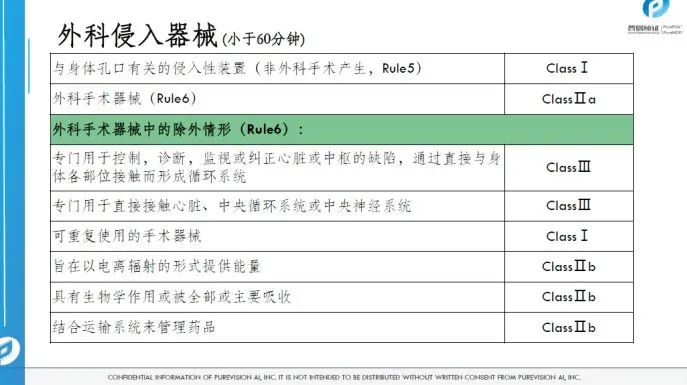
医疗器械的分类



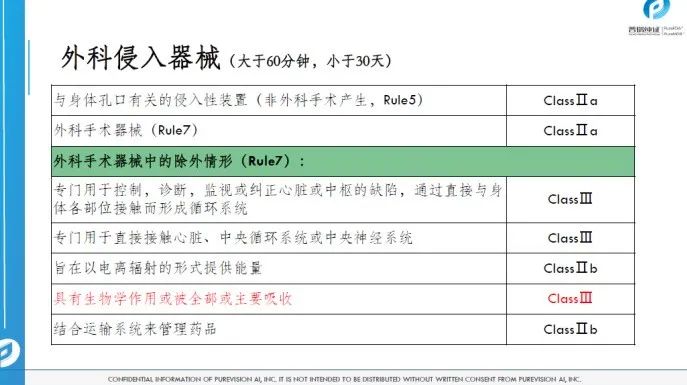
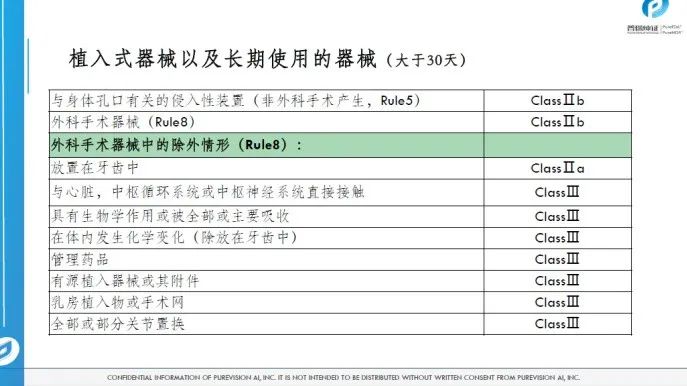



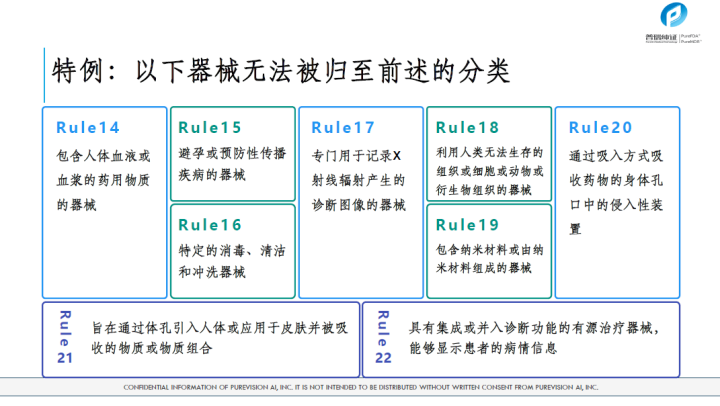
04
质量管理体系(QMS)




推荐阅读
关于我们

美国医疗器械注册认证服务
欧盟医疗器械认证服务
中国、巴西、加拿大、澳洲、韩国医疗器械认证服务
医疗软件AI注册认证服务


医疗器械 | 出口 | 认证|FDA CE | 行业热点 | 全球业务



本期内容分上下两集哦
01
欧盟从MDD过渡到MDR的监管之路解析









02
从MDD到MDR的主要变化及影响






03
医疗器械的分类












04
质量管理体系(QMS)




推荐阅读
关于我们

