如何当“标准”懂哥

主要国际医疗器械标准
符合国际标准为医疗器械生产商进入全球市场提供了机会。标准的名称通常由几个整数和几个数字的组合来表示。
标准开头的字母是发布机构的缩写,冒号前的数字是标准制定者分配的标准编号,冒号后面的数字是发布年份。
两个协会共同发布全球规范:
国际标准化组织 (ISO)
国际电工委员会 (IEC)
ISO标准
ISO 13485:2016 | 质量管理体系 (QMS) 的主要标准,旨在确保医疗器械得到正确设计、制造、交付和处置 |
ISO 9001:2015 | 是医疗器械制造商用来确保其产品质量的质量管理标准 |
ISO 27799:2016 | 为医疗器械制造商制定了有关患者个人健康信息保密性和安全性的要求 |
ISO 14001:2015 | 医疗器械公司必须建立减少浪费和节约能源的环境管理体系 |
ISO 50001:2018 | 医疗器械制造商可以建立能源管理系统,使他们能够不断提高能源效率 |
ISO 14971:2019 | 描述了医疗器械、作为医疗器械的软件和体外诊断医疗器械的风险管理指南 |
ISO 45001:2018 | 其中的一部分,定义了可用于医疗器械行业的健康和安全管理体系,以减少职业事故和相关责任问题 |
ISO 15223 - 1:2016 | 规定了用于医疗器械标签和随附文件以及包含医疗器械的包装的符号 |
ISO 16142-2:2017 | 其中的一部分,列出并定义了医疗器械安全和性能的基本原则,并确定了可用于评估医疗器械是否符合这些原则的标准和指南 |
ISO 18113-1 | 标准提供了体外诊断医疗器械制造商所需信息的一般原则和基本要求 |
IEC标准
IEC 62304:2006 | 规定了医疗设备软件的生命周期 |
IEC 62366-1:2015 | 医疗器械可用性是分析、指定、开发和评估医疗器械的过程。此外,它还描述了如何在正确使用设备期间评估和降低风险 |
IEC 82304-1:2016 | 制造商可以获得有关没有专用硬件的健康软件产品的安全性和安保性的指南 |
作为一家医疗器械制造商,ISO 合规性有助于证明其产品的高质量和安全性以及制造商对环境和消费者利益的关注。
FDA共识标准清单
在FDA公布的共识标准清单(Recognized Consensus Standards)的1463条数据通过团队小伙伴的分析后,也获得了专业任务小组统计情况,标准发展组织占比情况以及制定标准年份趋势统计。
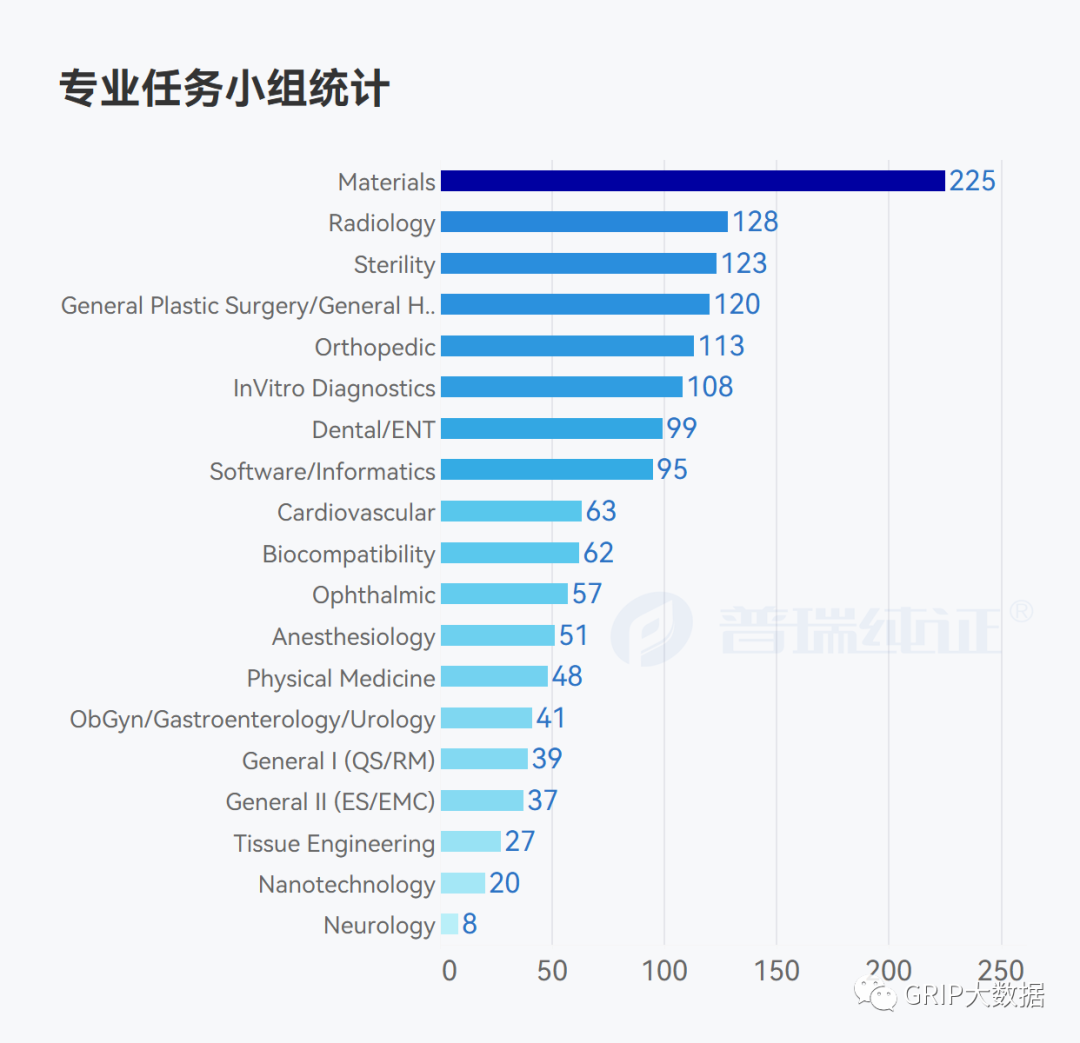
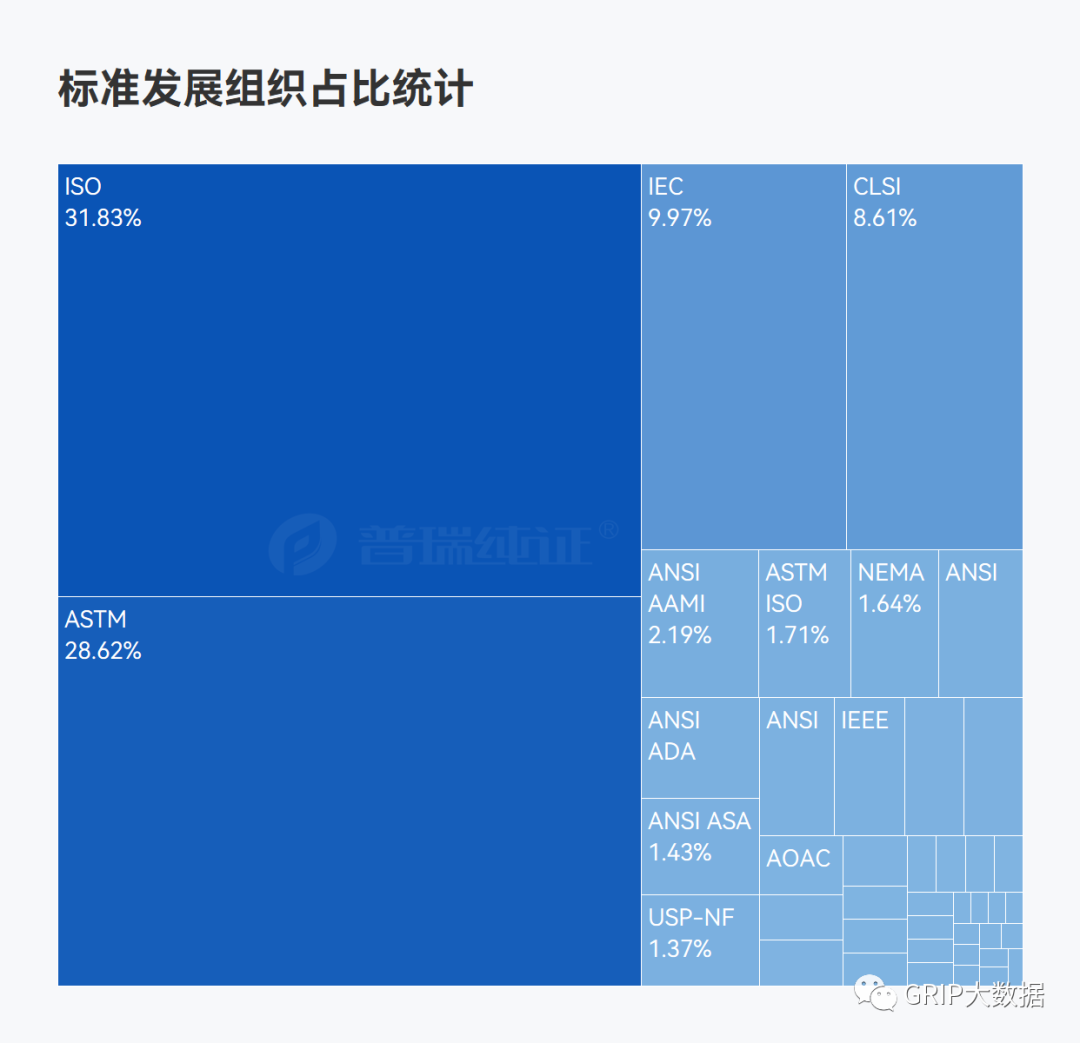
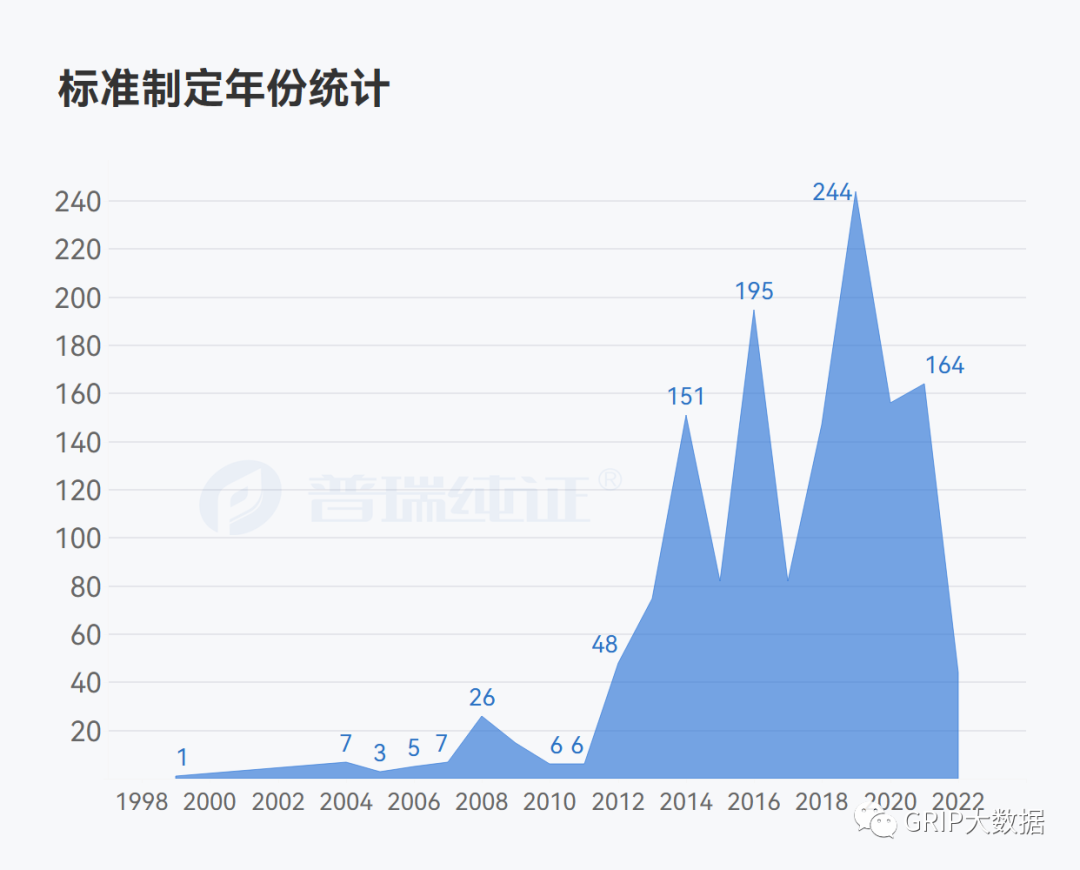
ISO 13485
ISO13485全称为《医疗器械质量管理体系用于法规的要求》(Medical device-Quality management system-requirements for regulatory )。ISO 13485是国际标准化组织(International Organization for Standardization,ISO)发布的一套国际公认的标准要求,旨在为医疗器械行业创建质量管理系统。
ISO 13485针对质量控制、风险管理、法律合规性、运营效率、可追溯性、流程和产品改进提出了质量管理要求,为生产医疗器械和相关服务的组织提供了巨大的优势,确保了对质量的承诺,并提高了组织内部的效率。

普瑞纯证携手GRIP平台(grip.purefda.cn)荣获全球范围内最具权威性的认证机构之一-- “英国标准学会”(British Standards Institution,BSI)颁发的ISO 13485质量管理体系证书。该证书已于2022年10月20日正式生效!这意味着普瑞纯证开辟了中国医疗器械CRO公司获得ISO 13485证书的先河!
这是全球范围内第一个服务+平台一起认证的ISO 13485证书,范围涵盖医疗器械法规咨询服务和医疗器械技术文件编写服务。
“GRIP大数据”是普瑞纯证旗下针对医疗器械行业的产研动态、科技资讯、数据分析、数据研报和可视化成果的资讯服务发布窗口。旨在为医疗器械行业从业人员带来基于Saas和Data打开全新的视角。
穿越周期,医械世界,分析有我,数读有你。
更多医疗器械全周期Saas+Data解决方案,欢迎访问grip.purefda.com,快速注册点击下方“阅读原文”或扫描下方二维码。

