指南解读|谁说Legacy Device不用写PSUR报告?

近日发布的MDCG 2022-21可谓是欧盟圣诞前的重磅炸弹,让关于上市后监管中定期安全更新报告(Periodic Safety Update Report,简称PSUR)的纷纷扰扰,终于尘埃落定。
首先说说PMCF,产品上市后临床跟踪研究(Post Market Clinical Follow-up)的计划和报告,是让当前要进行MDR的制造商尽折腰的文件,目前有相关的MDCG指南说明如何撰写,分别是MDCG 2020-7(PMCF计划模板)以及MDCG 2020-8(PMCF报告模板)。
相信很多制造商都在MDR注册中,被PMCF计划所提到的一般和特定方法/程序中信息来源要选用什么,具体的步骤要怎么定,以及选用上述方法和程序的适当性的理由所感到头疼。以上这些点,常常会出现在MDR临床表现文件的发补中,小编也希望各位制造商要好好撰写MDR和以上这两份模板,不要被难倒了(实在被难倒,也可以找普瑞处理)。
PMCF和PSUR是如影随形的,根据MDR法规,PMCF以及PSUR的更新要求如下:
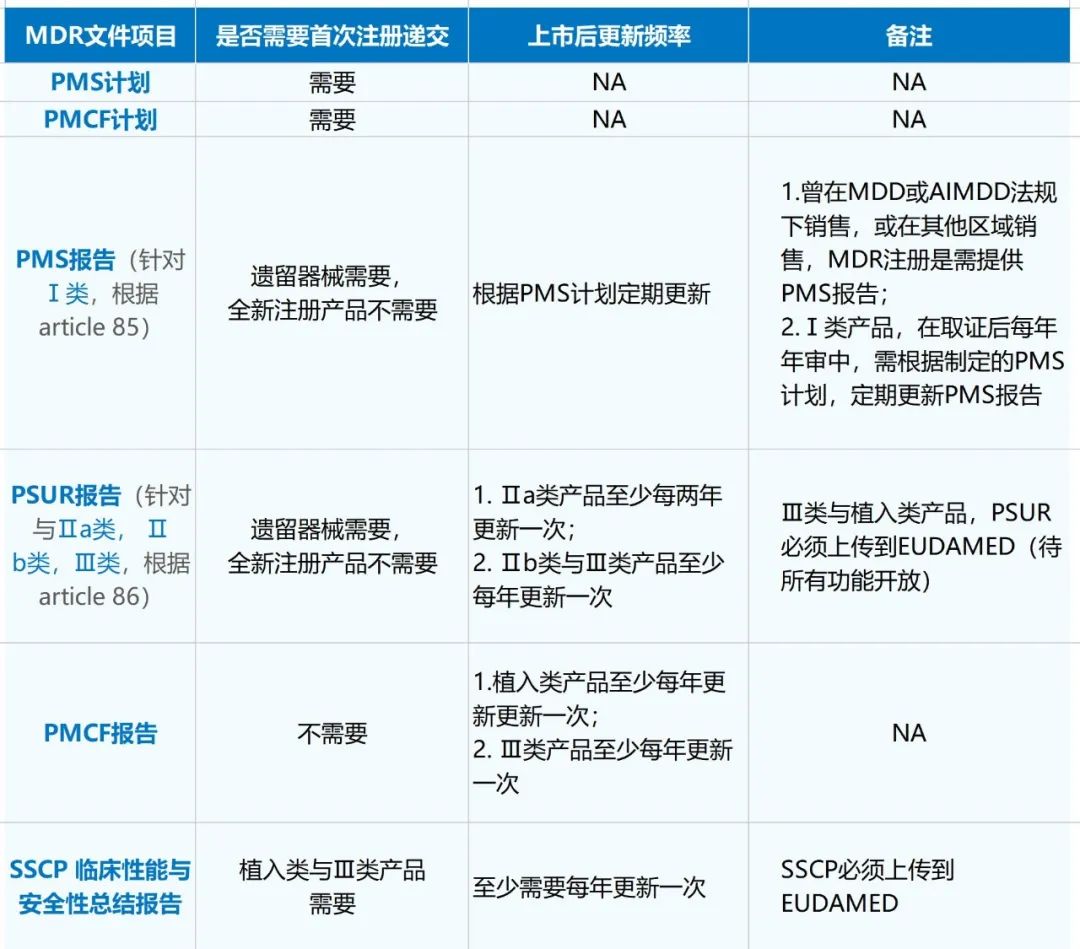
可以看出PMCF报告和PSUR报告都需要在产品获得MDR证书后进行数据采集报告汇编,并且随着产品的分类,对其更新的频率都各有要求。
PS:大家需要注意的是,虽然MDCG2022-21是一份针对医疗器械的PSUR指南,但不代表体外诊断试剂不用写PSUR,只是体外诊断试剂的PSUR会有其对应的指南。
PSUR,全称 PERIODIC SAFETY UPDATE REPORT,定期安全更新报告,可以理解是在PMS计划的上市后对应输出(Ⅰ类产品不属于PSUR范围)。既然是“定期”,则会非常强调每个周期的开始与结束时间,这些概念都在该指南中非常清晰地明确了,现在就由小编说一下该指南的重要注意事项:
明确了遗留器械在过渡期
需要写PSUR报告
即使之前很多指南文件都指出了遗留器械(Legacy Device)在递交MDR申请的时候,需要递交MDD或AIMDD时期的上市后监管数据,但很多制造商都是选择性不愿意相信要递交PSUR报告的事实,甚至是当年审时被NB提出发补了,也仍然是处于不愿意相信的状态(很难叫醒装睡的人),但现在指南就直接明确了遗留器械(Legacy Device)在过渡期需要写PSUR报告。
一般来说,现在新规下,欧盟市场上的医疗器械大概分成以下3种情况:
1. 全新产品获得MDR资质
这种情况最简单,就是直接从获得MDR证书的日期开始,作为PSUR周期计算的开始时间。
2. 遗留器械,并且在过渡期内会获得MDR资质(该类型应该占整个欧盟MD市场2/3)
从MDR发布的日子开始(2021年5月26号)就要开始做PSUR报告,该报告要覆盖整个产品的上市周期。
可以理解成从2021年5月26号后,要定期汇编PSUR报告,更新频率是12个月/24个月不等,第一份PSUR报告应该包含2021年5月26前所有的上市后信息。关于2021年5月26号前的上市后信息,是否汇编在第一份PSUR报告中,在当前所有的指南法规中都没明确,但是小编建议先这么操作,公告机构不满意会发补整改的。
对于这种情况的医疗器械,在获得MDR证书后,MDR时期的PSUR开始日期就不会再是MDR证书的日期,而是以遗留器械的产品的上一阶段PSUR结束日期为准。
需要注意的是,哪怕是遗留器械,在过渡期的PSUR报告更新频率也和MDR证书同步,其中Ⅱa类的产品每两年更新一次,Ⅱb类以及Ⅲ类的产品每年更新一次,这已经很明确了哦,不能再装糊涂了。
3. 遗留器械,并且在过渡期没计划能获得MDR证书
仍然需要在2021年5月26号开始定期汇编PSUR报告,但是在获得MDR证书后的第一份PSUR报告的起始日期会以MDR证书日期为准。

明确了PSUR报告需要
上传到EUDAMED
虽然这点之前很多指南、MDR法规也有提过,但是该指南更加细化了这个要求。
遗留器械在过渡期间的PSUR报告不需要上传到EUDAMED,但是对于MDR已获证的植入类和Ⅲ类产品,在EUDAMED所有功能完善后,在则需要按照更新频率要求定期更新并且上传到EUDAMED,其中除Ⅱa类植入是两年更新一次外,其他植入类、Ⅲ类产品都是需要一年更新一次的。

明确了Leading Device的定义
PSUR是可以以一个产品族的方式来完成。所以当制造商是有一个产品族的时候,是需要确定Leading Device。一般来说,Leading Device是在该产品族中风险级别最高的产品,但是如果产品族中有几款风险级别一样的产品的情况下,就需要制造商进行选定,并且提供合理的选择原因。
当Leading Device有显著产品性能优化的时候,后续的PSUR报告就不再是上一代产品族的延续,而是该产品族的新版本PSUR报告。
医疗器械可以在某款产品族中充当Leading device并且同时在其他的产品族中作为非Leading device。

提供了PSUR模板
该份指南对RA对显著的帮助(也有可能是困扰)就是提供了PSUR模板,模板的详情在附录Ⅰ已经写的非常清楚了,小编在这里扼要介绍一下:
> > 上下滑动查看更多 < <
以上就是关于MDCG2022-21的解读了,内容非常多,而且其实还有完全解读的部分,例如产品生命周期内都需要进行PSUR是怎么理解等。最后还是建议大家好好看看该指南,为日后的MDR注册的法规工作提前作准备。

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化 SaaS+Data 生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!

