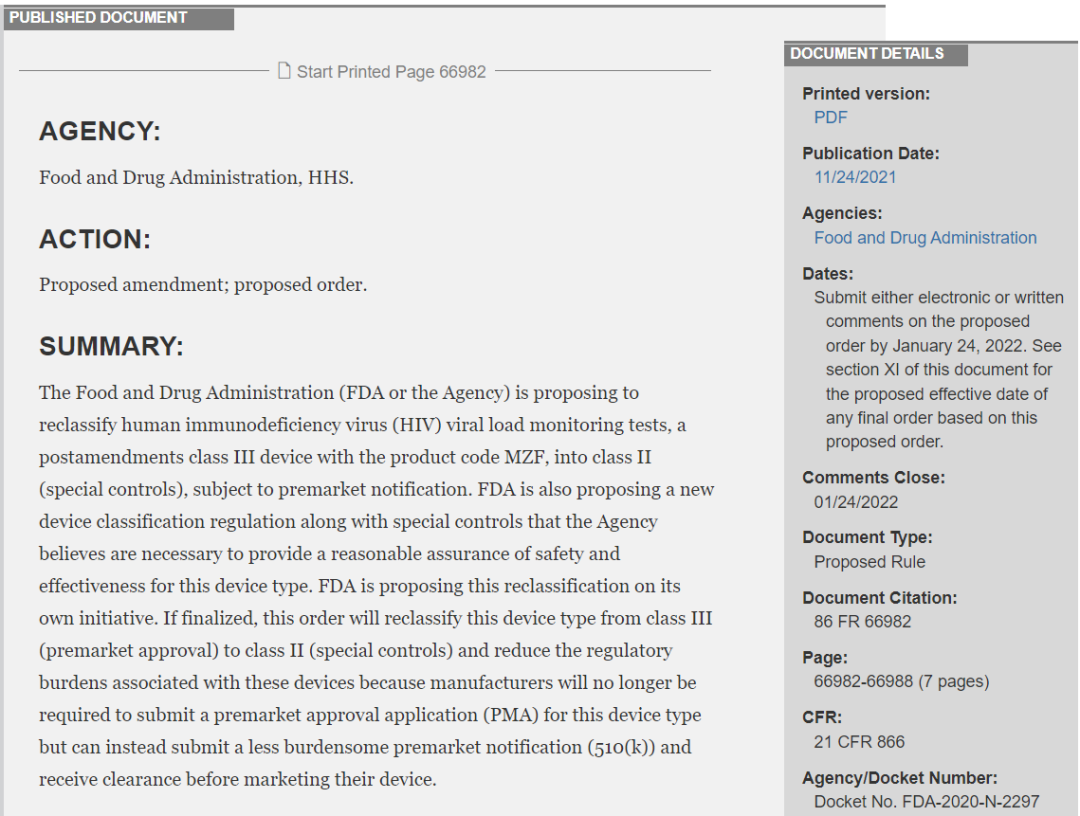
近日,美国食品和药物管理局(FDA)发布新规,确认将HIV(人体免疫缺陷病毒)病毒载量检测试剂进行重新分类,该类产品将由III类(上市前批准)变更为II类(特殊控制)。重新分类为II类(特殊控制)的相关产品,此后须遵守FDA的上市前通知要求。FDA还提出了一项新的设备分类法规以及由FDA认为必要的特殊控制措施,以便为这一设备类型提供合理的安全性和有效性保证。FDA主动提出这一重新分类的修订草案,目前处于拟定期;如果最终确定,这一重新分类将减轻这些设备相关的监管负担,因为制造商将不再需要为这种设备类型提交上市前批准申请(PMA),而是可以提交相对负担更轻的上市前通知(510(k)),并在销售其设备之前获得许可。普通和整形外科设备:普通腹腔镜动力粉碎收容系统被归入II类
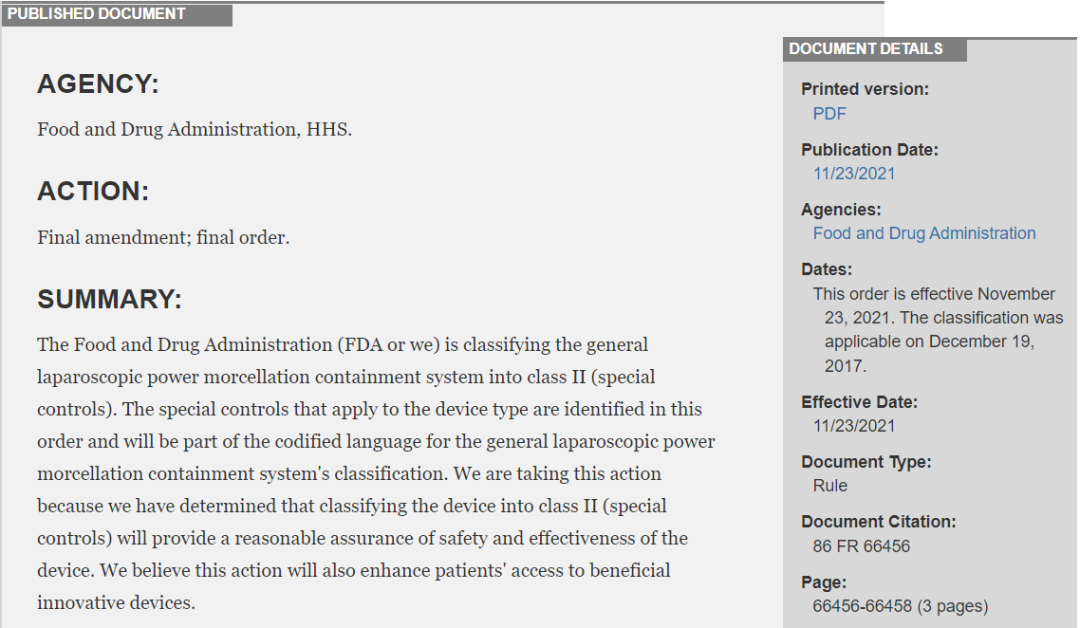
FDA还发布了最终修订命令,将普通腹腔镜动力粉碎收容系统归为II类(特殊控制)设备。按照此前的法规要求,类似的设备将会自动被分类为III类产品,而FDA此次的分类修订决定,是为了进一步增加患者获得使用有效创新医疗设备的机会。因此选择降低了这一设备的分类监管要求,使它们在上市前免于PMA(上市前批准)。这一分类命令已于2021年11月23日正式生效。
想要第一时间获取业内最新的重磅资讯?
请持续关注普瑞君公众号!
加入QQ群和微信群,与业内行家互动
Q群:726174626 群主微信号:purefda02
或添加顾问微信享受咨询服务
(二维码位于底部)

往期推荐

普瑞纯证是全球首家SaaS+Data的新型数字化跨境医疗器械CRO企业,我们的全球服务网络分布在包括中国、美国、英国、德国、荷兰、波兰、马耳他、香港等多个国家和地区。依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断、医疗软件AI等产品提供全球市场合规准入的全流程咨询服务,涵盖器械法规咨询,当地授权代表,产品认证注册,海外临床试验,技术文档与体系辅导,产品检测等全流程服务。🇺🇸 美国FDA厂家注册和产品登记认证,510K和NIOSH认证服务;🇪🇺 欧洲技术文件编写,欧盟PPE、MDR、IVDR CE认证;🇬🇧 英国、🇲🇽 墨西哥、🇨🇴 哥伦比亚、🇦🇺 澳大利亚、🇨🇦 加拿大等多国医械认证服务。
咨询服务
普瑞君 | 华南顾问
Aaron | 华南顾问
Benson |

| 
|  |
华东顾问
Katy | 华中顾问
Jack | 福建顾问
Howard |
 |  | 
|