亚洲市场 | 普瑞大数据告诉你香港注册的好处

香港MDD
在香港,医疗器械和体外诊断器械由香港卫生署(Department of Health)下属的医疗仪器科(Medical Device Division, MDD)监管。医疗仪器科(前称医疗仪器管制办公室)于2004年7月成立,负责推行医疗仪器行政管理制度,及制定长远的医疗仪器法定规管架构。
目前,香港并无立例管制医疗仪器的进口和销售事宜。在法例尚未制定之前,当局设立名为医疗仪器行政管理制度的行政管理制度,以利便相关各方顺利过渡至长远的法定规管模式。卫生署辖下的医疗仪器科,负责这个制度的运作。
”
医疗仪器行政管理制度的特点
● 设有医疗仪器表列制度,以让医疗仪器制造商和进口商根据这个制度自愿向卫生署表列其医疗仪器;
● 设有医疗事件呈报制度,以让制造商、进口商、使用者和公众通过这个制度,向卫生署报告有关医疗仪器的医疗事件,以便作出评估,务求减少医疗事件发生、避免事件重演或减轻事件再现的后果。

香港卫生署的医疗器械注册目前还是自愿的模式,所以并不是强制性的要求所有进入香港的医疗器械都获得当局备案或者注册后才能上市,而且没有相关官费产生。但是香港当局近期在网站上的更新,基本香港医院的采购或者其他使用医疗器械的场所是会优先考虑已经获得香港当局审核通过的企业的产品,所以这是一个隐性的要求,这也是注册变成非常建议的一个步骤。

产品需求分析和市场情况数据分析
由于香港的注册制度是认可NMPA申请路径和GHTF5国的证书,所以等于准入的范围是较为大的,有很多企业也可以通过申请香港的注册,从而回过头使用大湾区的优惠政策来进入大湾区的采购体系。
同时由于香港的审核细节和力度也不低,通过申报香港,企业的整个技术文件和能力都会被考核一轮,有助于企业提升企业的整个申报材料的质量和能力,但是有没有官费的负担。
● 注册主体部分,排名前列的是均是境外医疗器械巨头,非厂商首位的是Emergo hk 的109个;
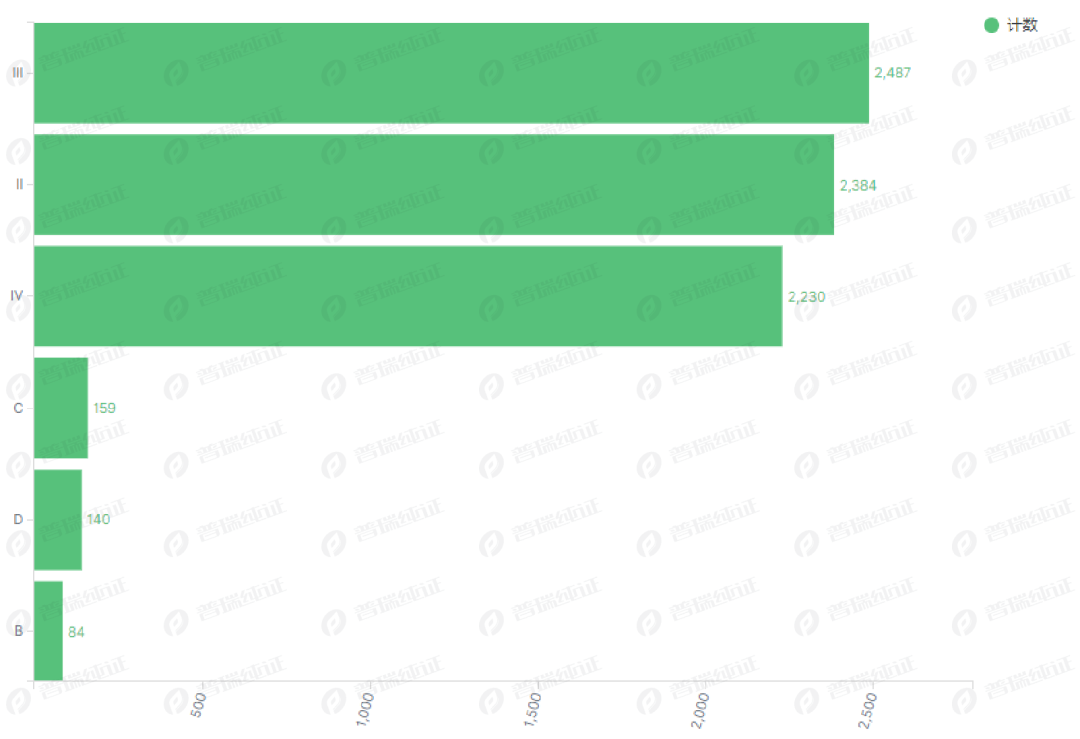
●产品主要集中在MD 2/3/4 分别为 2384/2487/2230(累计94%),IVD B/C/D 分别为 84/159/140(累计6%);
● 产品分类按照 AMDNS Code分布较为离散,前列的较多医用耗材;

● 制造商国家分布方面,最多为美国近 3000余家,中国仅有296家;

● 注册时间方面,从2019年开始逐年增加;美国企业注册了那么多,中国企业不到1/10,所以目前在中国制造商还不是大量进入的时候,是绝佳的开展注册和进入市场的时期;
普瑞纯证旗下全球准入自营业务中国香港特别行政区分公司Pure MDD,作为独立专业的第三方持证方,我们秉承着服务和专业并举的理念,除了及时响应客户的需求和双PM的工作模式,重要的是我们的法规咨询的专家团队和自营公司与香港卫生署在众多项目执行中建立了良好的关系和沟通的机制,使得我们能最快的给到各位制造商准确和及时的当地法规的一手信息和当局反馈。
有兴趣开拓香港市场的小伙伴欢迎咨询!