法规快讯 I 英国当局MHRA注册涨价了!

根据《2021 年药品和医疗器械法》第 45(1)条,MHRA 牵头与北爱尔兰卫生部就 MHRA 法定收费的拟议修正案进行了联合磋商。此次咨询于 2022 年 8 月 31 日至 11 月 23 日进行,旨在就更新 MHRA 监管服务法定收费的建议征求意见。根据《公共资金管理准则》,这些费用是在收回成本的基础上制定的,但已有数年未更新,无法完全收回成本。MHRA发出了咨询意见后,共收到 99 份答复。答复者普遍认为有必要确保监管活动的成本回收,这对于确保服务水平的一致性非常重要。
英国当局根据分析和反馈意见,确认针对这个卫生监管法定收费进行调整,推进新的收费标准,以确保监管当局长期财务的可持续性,提供反应迅速和创新高教的监管服务,从而醋精获得高质量,更加安全和有效,创新的医疗器械,保证和改善公众的医疗需求。
英国国家通过立法流程开始于2023年4月进行投票并决议后,英国医疗器械监管当局在本年7月开始执行新的收费标准。
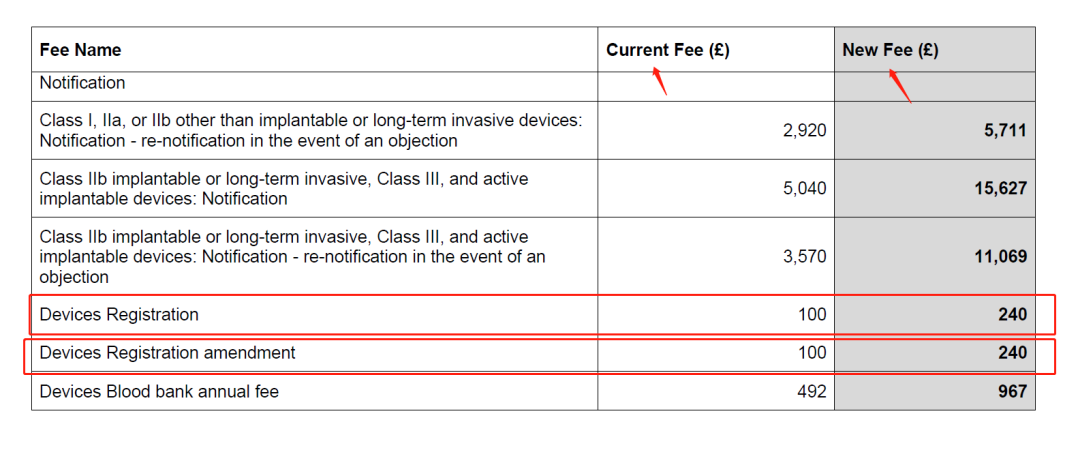
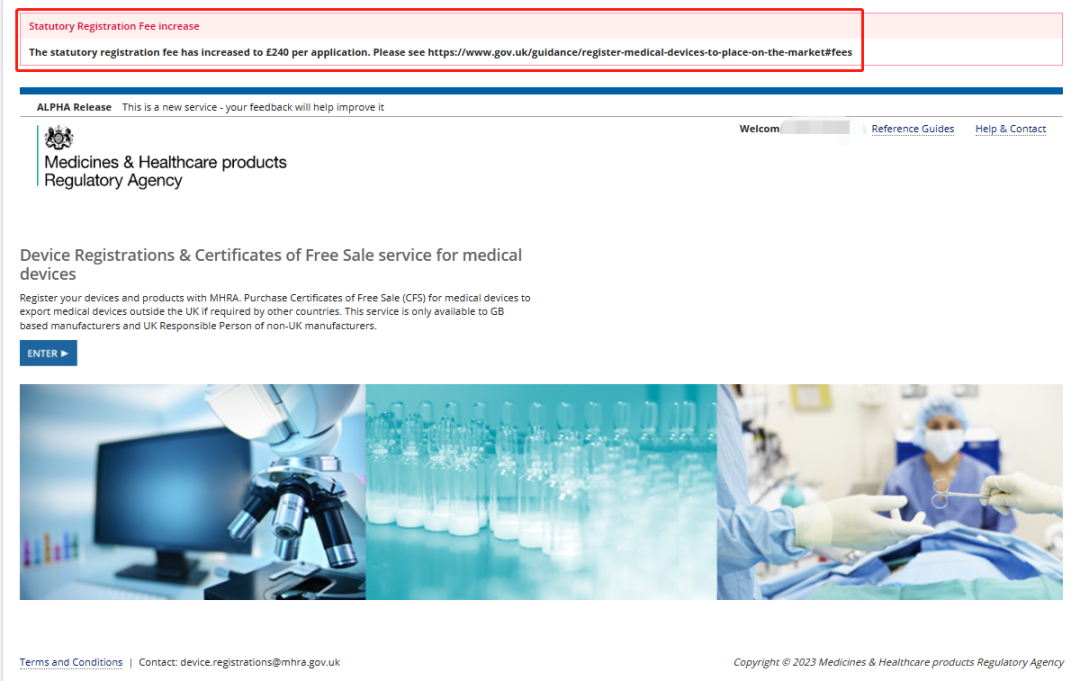
根据Annex A - MHRA statutory fee changes Table 2: Fees that increase above indexation to achieve cost-based recovery, 之前需要通过MHRA系统注册产品的费用由原来的100英镑上升到240英镑每个(根据每个GMDN Code进行收费);注册产品后进行产品修改(如涉及新的GMDN Code产品),费用也是由原来的100英镑上升到240英镑每个;
英国注册要点
UKCA是UK Conformity Assessment的简称。2019年2月2日,英国政府公布了在无协议脱欧的情况下将会采用的UKCA标识方案。这就意味着退欧之后,对英国的贸易将根据世界贸易组织(WTO)规则进行。欧盟的法律和监管将不再适用于英国。UKCA标志是一种新的英国产品标志,将在过渡期后用于医疗器械,在大不列颠市场上投放。
Part.1/ 如果制造商位于英国境外,必须指定一名英国授权代表 (UKRP)。对于非英国制造商所有带有 UKCA 或 CE 标志的产品,均必须符合这一要求。

(认证示意图;GB为英国大不列颠、NI为北爱尔兰、EU为欧盟)
从2021年1月1日起,英国负责人将代表英国以外的制造商,履行与制造商义务相关的特定任务。这包括在制造商的器械投放到英国市场之前向MHRA注册。
英国负责人的职责在UK MDR 2002中有描述。总之,英国负责人必须:
● 确保起草了符合性声明和技术文档,并在适用时,制造商执行了适当的合格评定程序。
● 保留技术文档、符合性声明、以及相关认证的副本(如适用),包括任何修改和补充,供MHRA检查。
● 应MHRA的要求,向MHRA提供证明器械符合性所需的所有信息和文件。
● 将MHRA提出的任何关于样品或访问器械的请求转发给制造商,并确保MHRA收到 样品或已获得访问器械的权限。
● 与MHRA合作,采取任何预防或纠正措施,以消除或减轻器械带来的风险。
● 立即告知制造商关于医疗保健专业人员,患者和用户的投诉和报告与指定器械有关的可疑事件。
● 如果制造商的行为违反了本法规规定的义务,则需终止与制造商的法律关系,并将终止的情况通知MHRA以及(如适用)相关的公告机构。
● 英国负责人的姓名和地址必须包括在产品标签或外包装上,或在已贴上UKCA标志的情况下的使用说明上。CE标记设备的标签上不需要包括英国负责人的详细信息,除非设备同时具有CE和UKCA标记。
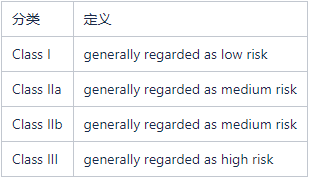
Part.2/ 医疗器械需要遵循英国产品分类规则
UK MDR 2002法规中将医疗器械分为四类:
Part.3/ 选择相应的注册路径在MHRA系统中完成产品注册并缴纳英国监管当局官费
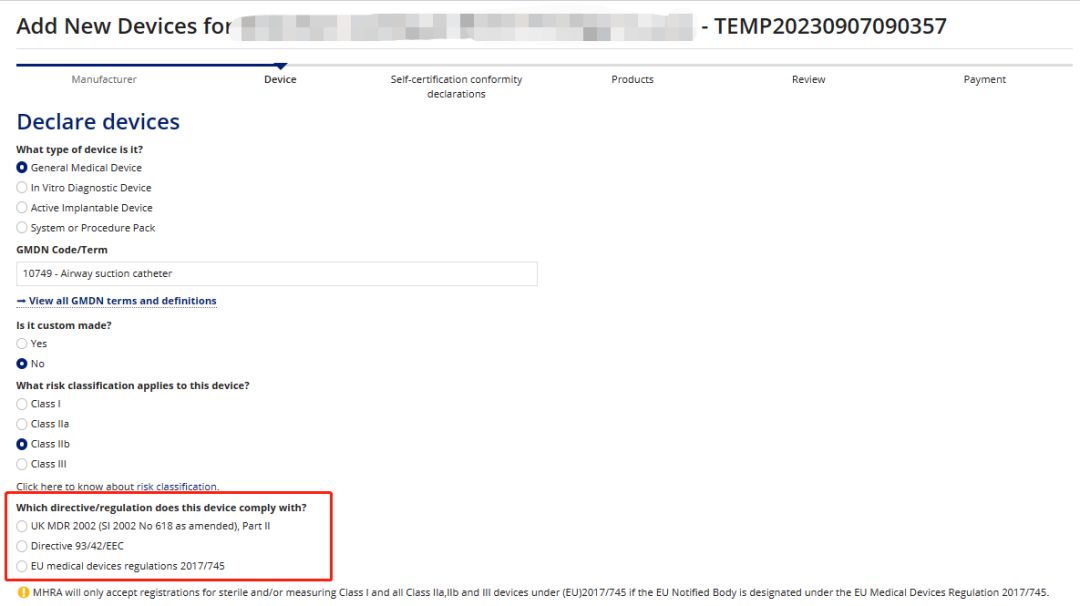
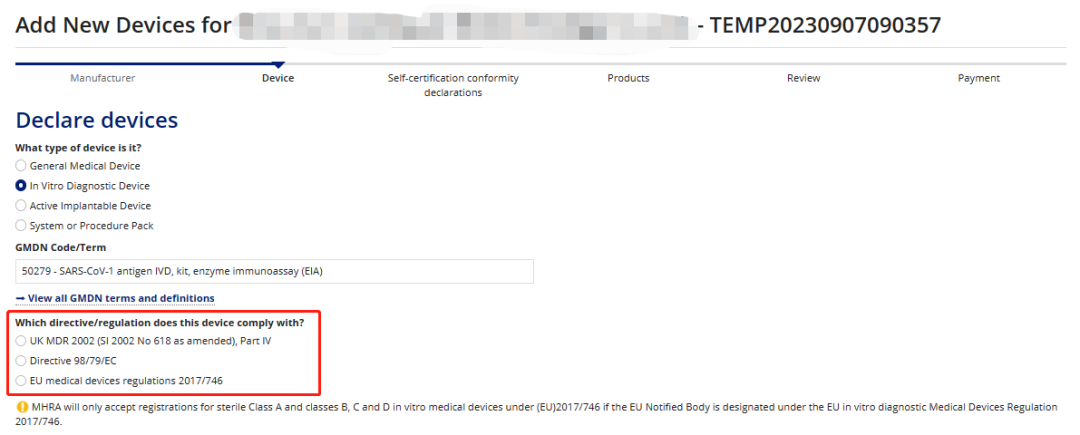
目前由于2023年6月英国刚出台了针对IVD新的过渡期的法案,所以目前脱欧后英国无论是MD还是IVD都有明确的注册路径可以选择。
普瑞英国当地公司通过自己的UKRP账户管理截图可以看到,目前已经开通了英国自己的审核路径,但是只是针对低风险的,同时高风险的产品如果要进入英国要么已经获得了CE并通过CE的路径进入(新规或者旧规),要么按照英国自己的法规UK MDR 2002(SI 2002 No 618 as amended), Part II & Part IV进行注册;
MD:
IVD:
Part.4/ 缴纳官费
每份注册申请需缴纳240英镑的法定费用
如果您的产品在出海前往英国的过程中有任何的疑问和新指南的深度定制化解读和路径规划,欢迎与我们的销售顾问进行沟通,我们当地自营公司将竭诚为您服务。


