快讯 | 时隔25年,FDA更新临床试验知情同意指南文件

当地时间8月15日,FDA已最终确定指导文件,以帮助伦理审查委员会 (IRB)、临床研究人员和申办方了解应遵守的临床研究知情同意规定。此次发布的长达66页的指南文件,是基于2014年7月发布的指南草案,用于取代1998年9月的指南文件。
指南文件对知情同意的基本要素做出了解释性说明,包括描述临床试验、向患者解释治疗的风险、不适和益处,以及在受伤时的赔偿和医疗救治。

该指南文件还涉及知情同意过程中伦理审查委员会(IRB)、临床研究者、申办方和 FDA 各方角色的职责明确,并附有一系列常见问题解答。
与指南草案相比,新增了关于胁迫和过度影响的例子。例如,FDA认为报销受试者往返临床试验现场的合理旅行费用(如机票、汽油、过路费等)及相关费用(如停车费、住宿费)不会引发胁迫和过度影响的问题。同时,其他费用的报销可以由伦理审查委员会(IRB)根据具体情况逐案考虑,IRB应考虑拟议的报酬是否构成过度影响,参与研究的报酬应公正合理。
最终版本还在“财务关系”部分明确了伦理审查委员会在财务安排方面的额外责任。尽管临床研究者应考虑这些与财务关系和利益相关的问题,但伦理审查委员会(IRB)有最终责任确定是否应在知情同意过程中向受试者提供有关资金来源、资金安排或临床试验相关方的财务利益的信息。
修订版还包括了一些新的常见问题解答,涉及以下内容:
在临床试验中招募儿童的注意事项;
招募语言沟通、理解、身体状况存在一定障碍或缺陷的受试者的注意事项;
招募知情同意能力受损的受试者的注意事项;
通过电子方式获得知情同意;
试验结束后,受试者是否应被告知整体研究结果。
海外临床资源
普瑞纯证作为专业的全球化CRO,我们秉承着服务和专业并举的理念,及时响应客户的需求,采用中美双PM的工作模式,定制化服务以满足客户在临床试验领域的特定需求。
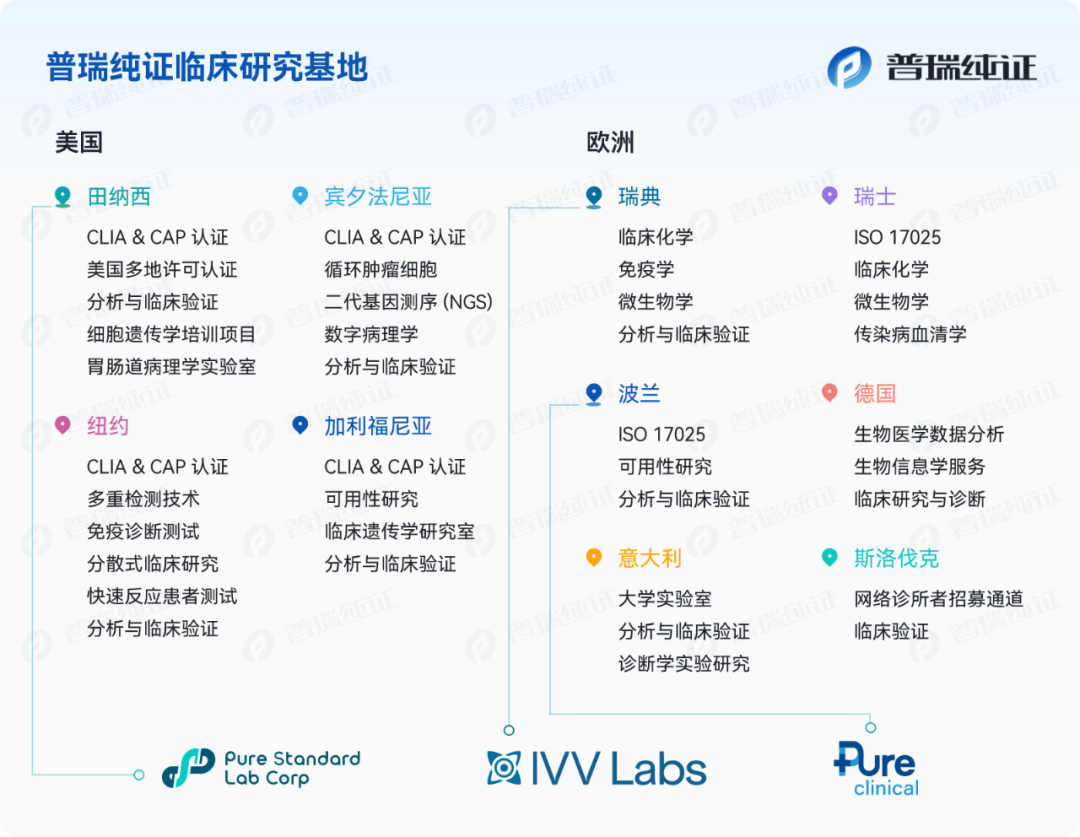
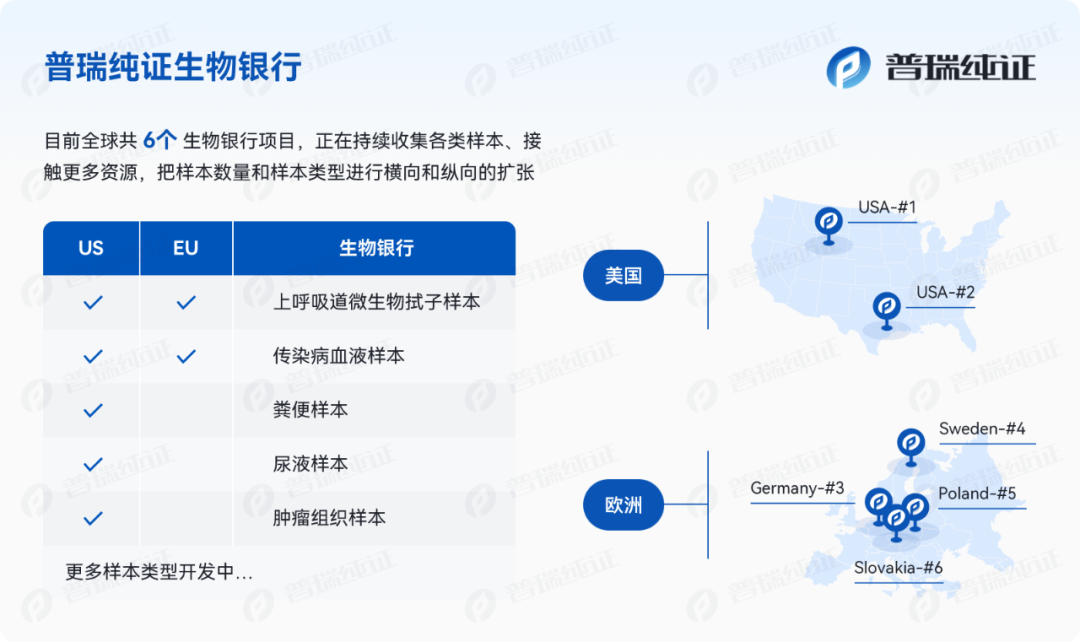
普瑞纯证在欧、美地区自营及合作的实验室资源优势:
拥有来自世界各地的研究人员和生物医学分析师团队,且团队拥有多为在欧、美各国临床领域工作数十年的专家;拥有丰富的法规知识,并与各地区临床监管机构建立了良好的工作关系;
具备多领域的临床、可用性研究、分析性能及性能验的测试经验(覆盖领域包括但不仅限于胃肠道病理学、细胞遗传学、数字病理学、毒理学、人工智能驱动算法病理学、呼吸道疾病检测和研究、皮肤医学、泌尿医学、免疫诊断、循环肿瘤细胞、女性健康医学等等);
样本类型多样,样本收集渠道丰富,可满足前瞻和回溯及其他试验要求(样本类型包括但不仅限于鼻拭子、鼻咽拭子、口咽拭子、血液、组织、唾液、痰液、皮损液等等);
实验室空间充足,配备了多台国际认可的仪器;

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化AI赋能生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,500万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
