2022年10月关于体外诊断医疗器械IVDR法规 (EU) 2017/746的联合实施和准备计划正式发布。该联合实施计划是MDCG(包括相关小组)根据利益相关者的意见进行审查的结果。它已在2021年5月28日的MDCG会议上原则上获得通过。除了确定优先事项外,这份计划还将作为监督实施的动态文件。项目的状态和时间线将被更新以反映IVDR的工作进展。
2022年10月关于体外诊断医疗器械IVDR法规 (EU) 2017/746的联合实施和准备计划正式发布。该联合实施计划是MDCG(包括相关小组)根据利益相关者的意见进行审查的结果。它已在2021年5月28日的MDCG会议上原则上获得通过。除了确定优先事项外,这份计划还将作为监督实施的动态文件。项目的状态和时间线将被更新以反映IVDR的工作进展。
众所周知,欧盟理事会和欧洲议会于2017年4月通过了一个新的医疗器械立法框架,包括关于医疗器械 (MDR) 的法规 (EU) 2017/745 和关于体外诊断医疗器械 (IVDR) 的法规 (EU) 2017/746。这一新框架为医疗器械设定了高质量和安全标准,旨在确保内部市场的平稳运行。
MDR原定于2020年5月26日实施,并且在2020年3月,MDCG小组批准了一项MDR的联合实施计划,该计划列出了成员国和欧盟委员会的一些优先行动并进行实时监测。相比之下,IVDR的实施日期为2022年5月26日,MDCG小组意识到有必要为IVDR 的实施开展类似的工作,因此有了此份IVDR联合实施计划。
从2017到2022,IVDR有5年的过渡期,这是为了留出更多时间来对行业的运作方式进行许多根本性的改变:新的器械分类系统、公告机构更多地参与器械的合格评定、新的监管结构,如欧盟参考实验室和专家组。
2020年来,COVID-19 的大流行进一步表明需要一个稳健的框架来确保欧盟诊断市场的高质量标准。但是所有参与者为应对 COVID-19 大流行做出的额外努力使情况变得更加复杂,欧盟利益相关者组织曾在报告中说,重大的不确定性阻碍了其成员为遵守 IVDR 而进行的规划和准备。事实证明,IVDR 的实施对整个行业和所有相关方(利益相关者、欧盟委员会和成员国)来说都是一项非常具有挑战性的任务。
为了迎接与实施 IVDR 相关的挑战,所有相关参与者都必须进一步加强努力并密切合作。此份文件重新评估了实施优先事项,主要目的是就短期内将有限的资源集中在何处达成一致,以确保在申请日期之前尽快交付。
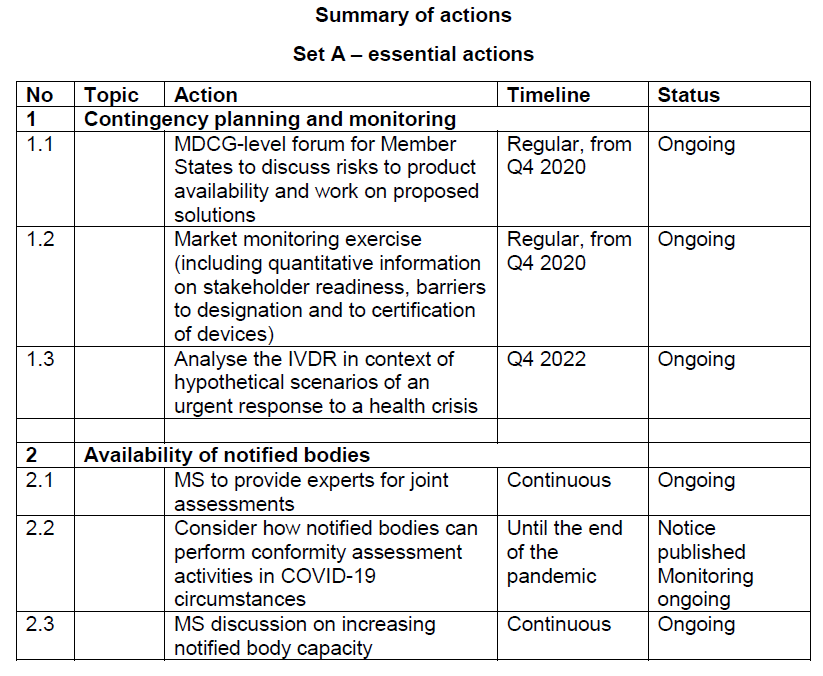
优先级分为两组,A 组包括对器械进入市场至关重要的行动(与应急计划框架和公告机构可用性相关的行动),B 组包括立法和指导文件,虽然不是强制性的,但将极大地促进参与者的工作以及为高风险 IVD 指定欧盟参考实验室。
A组——必要行动
1. 应急计划和监测
优先行动:
1.1 参与 MDCG 级别的论坛,就与 IVDR 实施相关的关键问题、潜在的短缺风险以及为确保安全和关键 IVD 的可用性而采取的措施进行交流。(委员会,MDCG)1.2 进行市场监测,尽可能多地获取有关不同利益相关者准备情况的数据,并旨在发现可能导致市场上器械短缺的障碍。(委员会、CAMD)1.3 在紧急应对健康危机的假设情景、要考虑的情景和要定义的方法的背景下分析 IVDR。(委员会,MDCG IVD WG)2.1 实现各国家专家们和公告机构进行联合评估。(成员国)2.2 考虑公告机构如何在 COVID-19 情况下进行合格评定活动。(委员会,MDCG)2.3 成员国关于提高公告机构能力的讨论。(MDCG、MDCG NBO WG、MDCG IVD WG、委员会)3.1 与成员国讨论与欧盟参考实验室相关的实际问题。(委员会,MDCG/MDCG IVD WG)3.2. 通过关于实施法案关于欧盟参考实验室的任务,标准以及征收的费用(委员会,医疗器械委员会)3.3 开展欧盟参考实验室所需能力调查。(委员会)3.4 向成员国和联合研究中心(委员会)发出申请征集。3.6 调查联盟对费用未涵盖的任务的贡献。(委员会)4.1 提出 CS 集作为第一轮采用的一部分。(委员会)4.2 同意即将采用的文本作为第一轮的一部分。(MDCG IVD WG、MDCG、委员会)4.3. 通过第一个包含通用规范的实施法案。(委员会、医疗器械委员会)5.1 完成并批准公告机构指定代码的指南。(MDCG NBO WG、MDCG IVD WG、委员会、MDCG)5.2 完成并批准公共机构的批次测试指南。(MDCG NBO WG、MDCG IVD WG、委员会、MDCG)5.3 制定关于 IVDR 第 110(3) 条中提及的重大变更的指南。(MDCG NBO WG、MDCG IVD WG、委员会、MDCG)5.4 根据 IVDR 第 110(3) 条制定适当监督指南。(MDCG NBO WG、MDCG IVD WG、Commission、MDCG)6.1 完成并批准关于 IVD 临床证据的指南。(MDCG IVD WG、MDCG CIE WG、MDCG)6.2 根据专家小组的意见,制定并批准关于什么是“器械类型”以及公告机构应遵循的流程的说明。(MDCG NBO WG、MDCG IVD WG、MDCG)6.3 开发和批准安全和性能概要模板。(MDCG IVD WG、MDCG CIE WG、MDCG)6.4开发和批准性能研究申请/通知模板。(MDCG CIE WG、MDCG IVD WG、MDCG)7.1 通过关于 MDR/IVDR 标准化要求的实施法案(委员会、标准委员会)并接受它。(CEN/Cenelec)7.2 通过关于在 OJEU 中发布支持 IVDR 要求的欧盟协调标准参考的实施法案。(委员会)8.1 考虑医药产品主管部门的咨询,配合 EMA 和利益相关者的工作,特别是在程序化要素方面。(MDCG IVD WG、医药产品主管部门、EMA)9.1 制定解释In-house器械规定的指南。(MDCG IVD WG、MDCG MS WG)10.1 制定并批准指南关于将 IVDR 要求应用于“遗留设备”和 2022 年 5 月 26 日之前根据指令 98/79/EC投放到市场的器械。(MDCG IVD WG, MDCG NBO WG, MDCG PMSV WG, MDCG MS WG, MDCG)11.1 在 Eudamed 完全发挥作用之前,制定和批准关于统一管理规范和可选择的技术解决方案的 IVDR 特定指南。(MDCG Eudamed WG、MDCG IVD WG、MDCG)上述短期优先事项应在 2022 年 5 月 26 日之后所有参与者在中期和长期行动战略计划框架内持续确定优先次序的背景下看待,此份实施计划以提供在可用资源的范围内完善 IVD 的最佳可实施的法律框架。例如进一步的指南有关于性能研究、安全性和性能总结、In-house器械、伴随诊断和医药产品临床试验中使用的器械资质认证等。同时委员会也致力于让 MDCG 定期更新 Eudamed 全面功能的总体进展情况。
还有不可忽视的一点,在市场监督和警戒方面的合作与协作是确保市场上设备安全的关键,关于这些要求应用需要更加明确。总而言之,伴随欧盟实施IVDR的决心与努力,广大的制造商们也做好攻坚战的准备,一起迈入IVDR时代。
普瑞纯证是行业领先的全球化 SaaS+Data 生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
 2022年10月关于体外诊断医疗器械IVDR法规 (EU) 2017/746的联合实施和准备计划正式发布。该联合实施计划是MDCG(包括相关小组)根据利益相关者的意见进行审查的结果。它已在2021年5月28日的MDCG会议上原则上获得通过。除了确定优先事项外,这份计划还将作为监督实施的动态文件。项目的状态和时间线将被更新以反映IVDR的工作进展。
2022年10月关于体外诊断医疗器械IVDR法规 (EU) 2017/746的联合实施和准备计划正式发布。该联合实施计划是MDCG(包括相关小组)根据利益相关者的意见进行审查的结果。它已在2021年5月28日的MDCG会议上原则上获得通过。除了确定优先事项外,这份计划还将作为监督实施的动态文件。项目的状态和时间线将被更新以反映IVDR的工作进展。