法规解读 | 针对新冠试剂,CS指南与MDCG 2021-21 Rev.1的详细对比!

Table 2中,与MDCG 2021-21 Rev.1相比,CS指南除了语言上进行了更新外,还详细标注了关于表格上特定部分的解释和规定,例如:
对于positive specimens(阳性样本),应提供样本采集与出现症状之间的时间间隔;
sensitivity(敏感性)是需要以新冠PCR产品的阳性结果作为对比试剂进行计算;
first 21 days after symptom onset(症状发生后的头21天),补充了灵敏度是与这个时间间隔相关的;
comparator device(对比器械),补充了对比器械最好是CE认证的IVDR Class D产品;
negative specimens(阴性样本),补充了阴性样本应来自没有新冠感染病史的个体;
non-vaccinated individual(未接种疫苗的个体),可以纳入一些接种了非新冠疫苗的个体;
有了比较显著的变化,更加详尽和明确了对于假阳性样品的检测设计。

Table 4中,
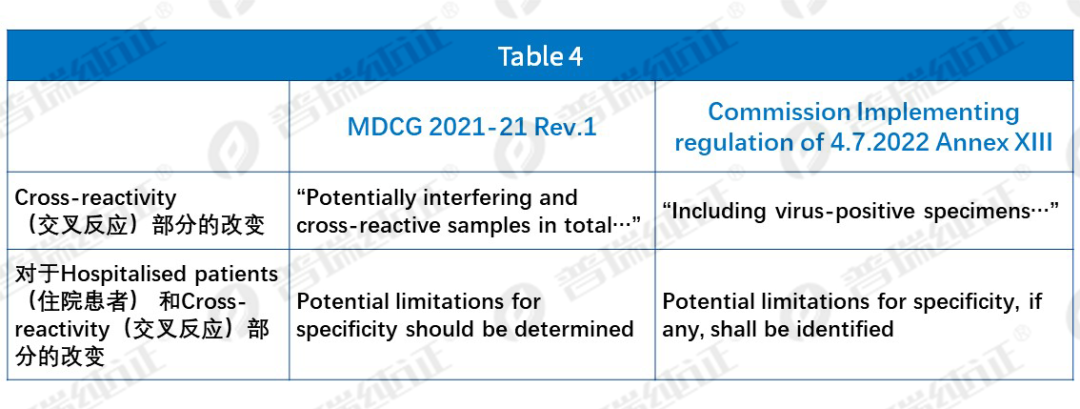
Table 6中,CS指南对比MDCG 2021-21 Rev.1,虽删除了Criterion,但添加了相关的标注,例如:
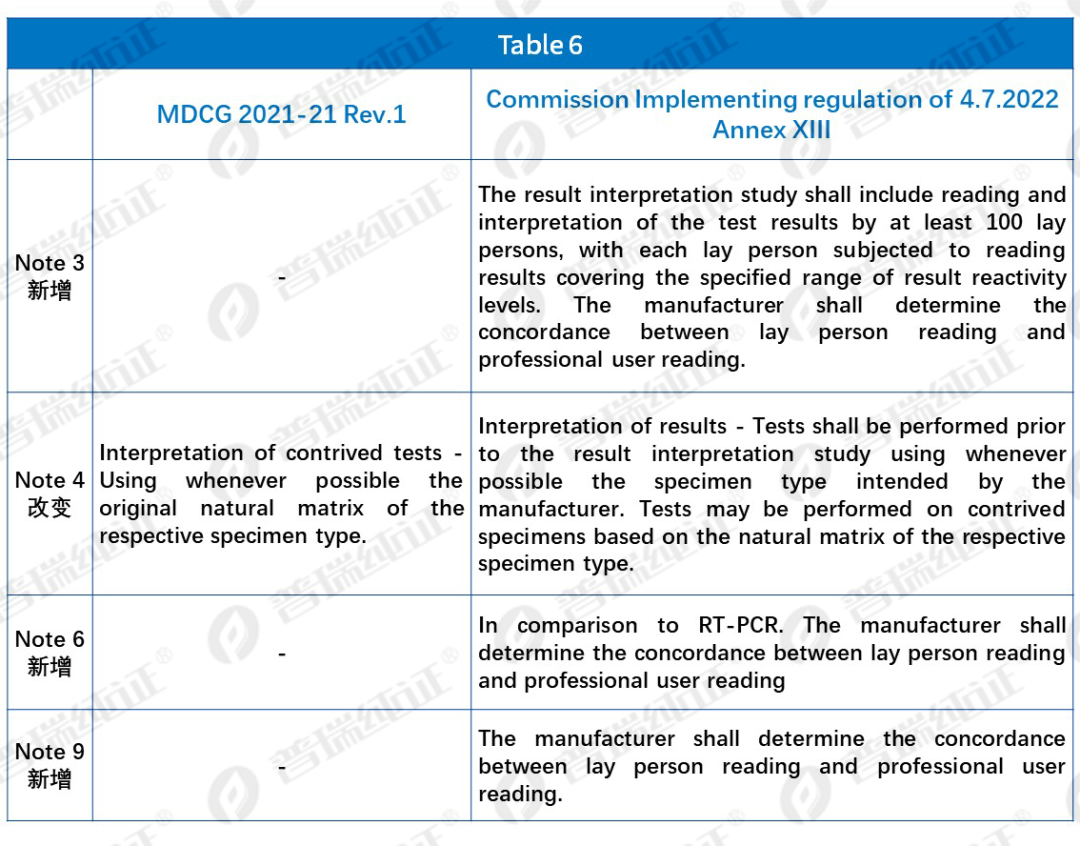
Table 7中,与Table 6类似,CS指南中删除了Criterion,也添加了相关的标注,例如:





