CE认证 | 收藏!一次性血液灌流器注册常见问题大全!

产品介绍
预期用途:
血液灌流器(即一次性使用血液灌流器),是开展血液灌流必不可少的关键医疗器械,主要应用于急慢性药物中毒、尿毒症中分子毒素吸附,肝病及免疫领域致病因子的吸附。其主要的应用方式有单独的血液灌流模式、血液透析联合血液灌流模式及血浆分离吸附模式。
产品分类:
根据REGULATION (EU) 2017/745附件八第三章第3条规则,所有用于改变人体组织或细胞、血液、其他体液或其他拟植入或施用到体内的液体的生物或化学成分的非侵入性设备均被列为IIb类器械。
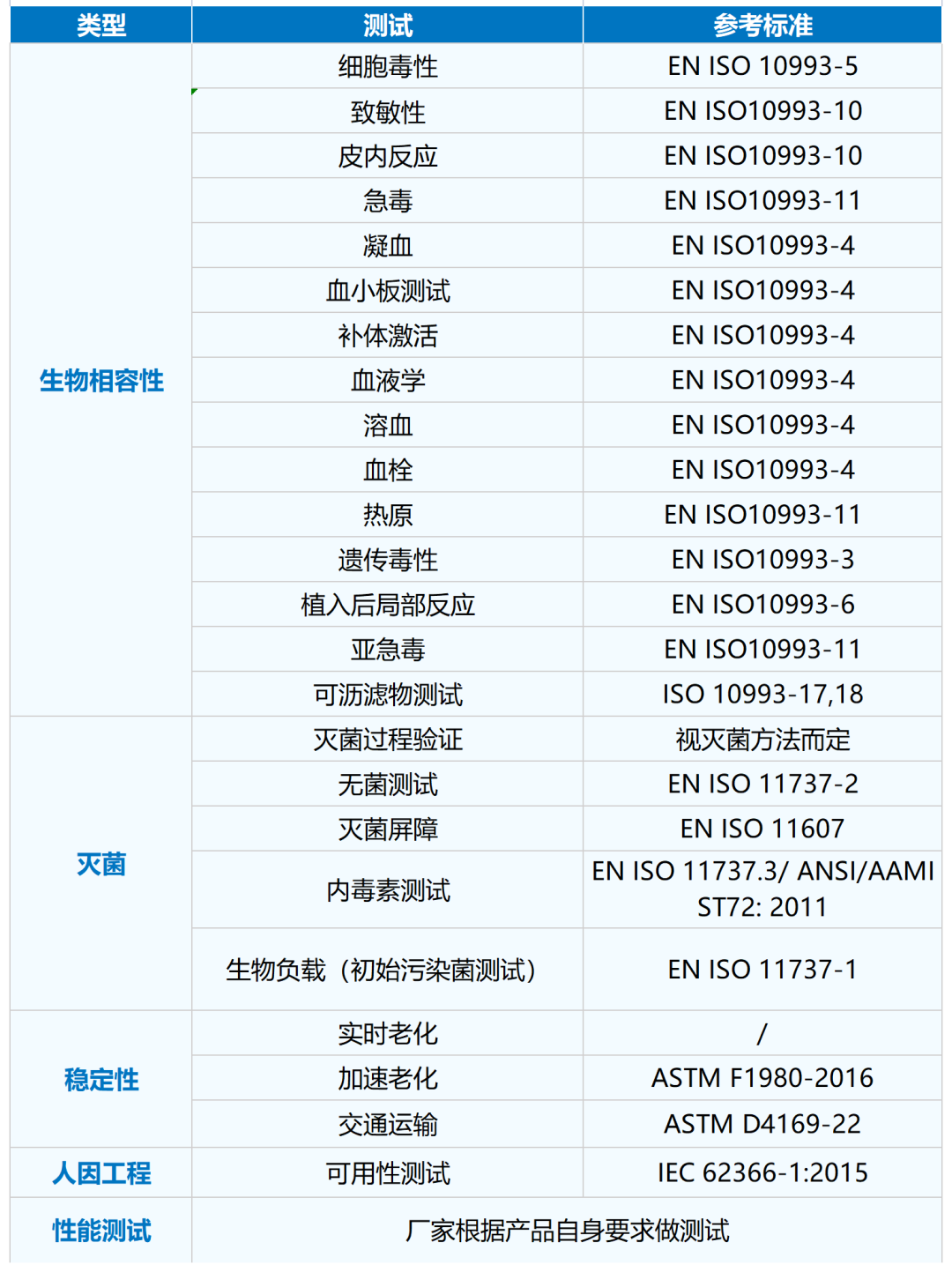
CE认证需要的
测试项目及参考标准
CE文件技术文档清单
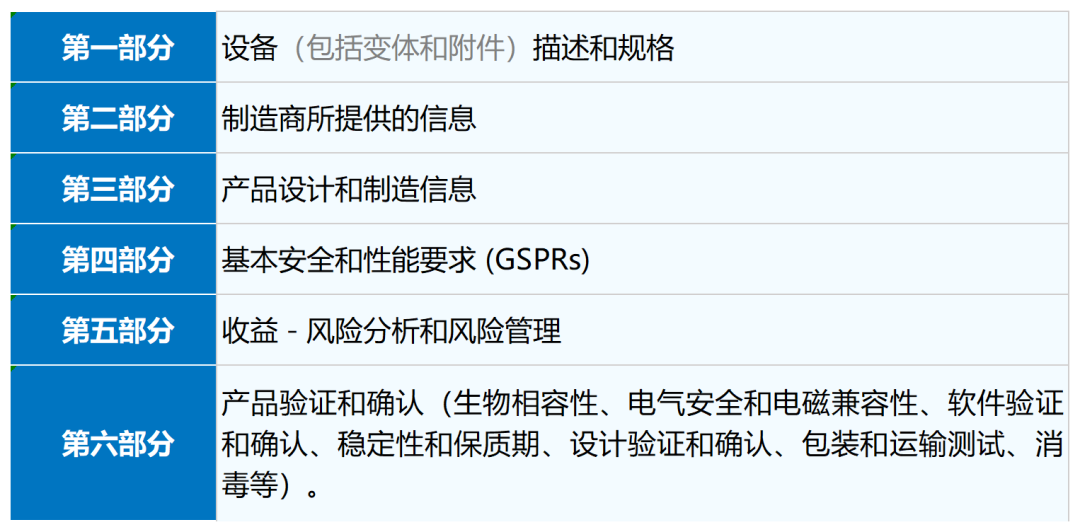
详见MDR法规ANNEX II
注意:具体文件架构随不同公告机构的要求而定,但文件内容区别不大。
注册流程
第一步:制造商确定医疗器械产品是否符合欧盟法规的定义、分类路径以及符合路径
第二步:制造商执行质量管理体系(如ISO 13485)
第三步:根据医疗器械的分类,制造商准备有关技术文档资料
第四步:制造商指定欧洲授权代表、申请SRN、Basic UDI-DI
第五步:公告机构对质量管理体系和技术文档进行符合性评估
第六步:公告机构根据技术文档、质量体系审核结果,提出发补整改意见
第七步:制造商根据整改意见进行整改
第八步:公告机构再评估无误后,下发证书
第九步:制造商签订自我符合性声明文件,欧洲授权代表注册备案后,开始在欧洲市场上销售
审核过程中普遍存在的问题
灭菌验证是否有效果,产品和灭菌包装是否满足无菌要求,是否有内毒素残留
临床评估过程中,临床数据的充分性和有效性,宣称的适应症和治疗模式的临床有效性和安全性是否已充分评估,风险收益比是否合理
生物学测试和评价是否足够充分,生物学风险,特别是在血液相容性方面是否在合理可接受的范围
风险管理和控制是否充分,风险管理有否贯穿产品的整个生命周期,关于产品上市后的临床不良反应风险是否已控制在可接受范围
我们可提供的服务
协助企业进行产品分类及明确分类路径
协助企业就技术文档资料进行差距分析
协助企业申请SRN、Basic UDI-DI
风险管理分析
临床试验/评估
DoC编写
协助企业完成发补
欧盟授权代表
参考资料:
[1] REGULATION (EU) 2017/745 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL

-普瑞纯证官方咨询顾问-
-获取最新业内资讯-

关于我们
普瑞纯证是行业领先的全球化 SaaS+Data 生命科学服务商,我们的全球服务网络覆盖了包括中国、美国、英国、德国、荷兰、波兰、香港等多个国家和地区。
依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断产品等提供全球市场合规准入的全流程咨询服务,以及海外临床试验等一站式解决方案。100+ 国家准入,1000+ 海外注册/认证成功案例,60万+ 全球经销商数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据。从市场战略到法规咨询,助力您的产品全方位顺利合规走向全球市场!
