2022年6月16日,美国食品和药物管理局(FDA)发布了《放射设备上市前提交的定量成像功能性能评估指南》终版。该指南文件旨在指导制造商准备包含定量成像功能的放射设备的上市前提交的资料,适用于上市前批准申请 (PMA)、人道主义器械豁免 (HDE)、上市前通知 (510(k)) 提交、研究器械豁免(IDE)和再分类(De Novo)等申请。该指南文件阐明,一般而言,为包含定量成像功能的放射学设备准备上市前提交的制造商应提供定量成像功能的性能规格,支持性能数据以证明定量成像功能符合这些性能规格,并为最终用户提供足够的信息,从而使他们能够够获取、理解和解释定量成像功能提供的值。
2019年4月19日,美国食品药品监督管理局(FDA)发布了《定量成像功能性能评估申报指南》草案征求公众建议。FDA 在考虑了收集的意见的基础上,酌情修订了该指南,并于2022年6月16日发布了最终版本,阐明了该指南旨在为具有定量成像功能的放射设备提供建议以及一些其他技术说明。
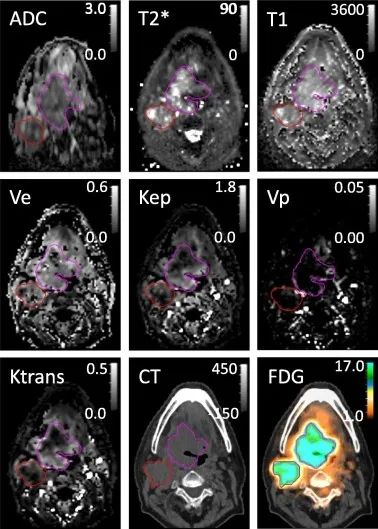
定量成像是指对医学图像量值的测量,定量成像值即医学图像量值的测量值,常为比值或差值,不含序数值和名义值,如核医学的标准摄取值(SUV)、磁共振的弛豫时间(T1、T2)、CT的体积测量值等。
定量成像性能评估主要采用线性度、精度、重复性、再现性、范围限值等指标。其中,线性度是指测量值与其真实值成正比的能力,精度用于反映特定条件下重复测量获得的测量值之间的一致性,重复性和再现性分别表示在相同和不同条件下的测量精度,范围限值是指测量值的下限值和上限值。定量成像风险主要来自测量的误差和不确定度,可能会影响临床决策结果。其中,误差是指定量成像值与其真实值之间的系统差异,包括系统误差和随机误差。不确定度是指测量值的合理分散度,常用置信区间表示。定量成像涉及多种成像模式,测量算法各异,产品预期用途广泛,因此难以建立通用评价标准,需要结合产品特性开展相关验证与确认工作。如需下载这份指南,请在公众号后台回复【定量成像】,即可获得下载链接。
普瑞纯证是全球首家 SaaS+Data 的新型数字化跨境医疗器械 CRO 企业,我们的全球服务网络分布在包括中国、美国、英国、德国、荷兰、波兰、马耳他、香港等多个国家和地区。依托法规认证与临床经验丰富的全球顶尖专家服务团队,普瑞纯证为医疗器械、体外诊断、医疗软件 AI 等产品提供全球市场合规准入的全流程咨询服务和海外临床试验等一站式解决方案。100+ 国家准入咨询,1000+ 海外注册/认证成功案例,60万+ 全球经销商大数据,100万+ 全球临床试验数据,300万+ 全球医械注册数据库。从市场战略数据到法规咨询,助力您的产品全方位顺利合规走向全球市场!